Hoà tan m gam Cu vào 200 gam dd H2SO4 đặc nóng x% vừa đủ thu được dd X và 3,7185 lít khí SO2 (đkc) (sản phẩm khử duy nhất). a)PTHH b)tính m,x và nồng độ phần trăm dd X
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a, \(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
\(Cu+2H_2SO_{4\left(đ\right)}\underrightarrow{t^o}CuSO_4+SO_2+2H_2O\)
b, Ta có: \(n_{H_2}=\dfrac{2,479}{24,79}=0,1\left(mol\right)\)
\(n_{Zn}=n_{H_2}=0,1\left(mol\right)\)
\(n_{SO_2}=\dfrac{2,9748}{24,79}=0,12\left(mol\right)\)
\(n_{Cu}=n_{SO_2}=0,12\left(mol\right)\)
\(\Rightarrow m=m_{Zn}+m_{Cu}=0,1.65+0,12.64=14,18\left(g\right)\)
Có: \(n_{H_2SO_{4\left(đ\right)}}=2n_{SO_2}=0,24\left(mol\right)\Rightarrow x=m_{ddH_2SO_4\left(đ\right)}=\dfrac{0,24.98}{98\%}=24\left(g\right)\)

Đáp án C
Coi hỗn hợp X gồm các nguyên tố Fe (x mol) , O (y mol) và Cu (z mol).
=> Hai muối sunfat là Fe2(SO4)3 (x/2 mol) và CuSO4 (z mol)


\(n_{SO_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\\ n_{CuSO_4}=\dfrac{48}{160}=0,3\left(mol\right)\)
PTHH:
Cu + 2H2SO4 ---> CuSO4 + SO2 + 2H2O
0,2 0,2 0,2
CuO + H2SO4 ---> CuSO4 + H2O
0,1 0,1
\(m=0,2.64+0,1.80=20,8\left(g\right)\)

Câu 1. cho 7,36 gam hỗn hợp X gồm Fe và MgO tác dụng với dung dịch H2SO4 đặc nóng, dư. Sau phản ứng thu được dd Y và 2,016 lít khí SO2 (đktc, sản phẩm khử duy nhất). Tính phần trăm khối lượng từng chất trong hỗn hợp X?
Giải
2Fe + 6H2SO4 đ,n => Fe2(SO4)3 + 3SO2 + 6H2O
MgO + H2SO4 đ,n => MgSO4 + H2O
nSO2 = V/22.4 = 2.016/22.4 = 0.09 (mol)
Theo pt => nFe = n.M = 0.06 (mol)
mFe = n.M = 0.06 x 56 = 3.36 (g)
% m Fe = 3.36x100/7.36 = 45.65 %
% m MgO = 100 - 45.65 = 54.35 %
Câu 2. cho m gam hỗn hợp X gồm Cu và Fe2O3 tác dụng với dd H2SO4 đặc nóng, vừa đủ. Sau phản ứng thu được dd Y và 1,12 lít khí SO2 (đktc, sản phẩm khử duy nhất). Cô cạn dd Y được 20 gam muối khan. Tính giá trị m?
Giải
Cu + 2H2SO4 đ,n => CuSO4 + SO2 + 2H2O
Fe2O3 + 3H2SO4 đ,n = >Fe2(SO4)3 +3H2O
nSO2 = V/22.4 = 1.12/22.4 = 0.05 (mol)
Theo pt => nCuSO4 = 0.05 (mol)
mCuSO4 = 0.05x160 = 8 (g)
=> mFe2(SO4)3 = 20 - 8 = 12 (g)
=> nFe2(SO4)3 = 12/400= 0.03 (mol) = nFe2O3
==> mCu = n.M = 0.05 x 64 = 3.2 (g)
==> mFe2O3 = n.M = 0.03x160 = 4.8 (g)
Vậy m = 3.2 + 4.8 = 8 (g)

\(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right);n_{SO_2}=\dfrac{10,08}{22,4}=0,45\left(mol\right)\)
PTHH:
Fe + 2HCl ---> FeCl2 + H2
0,2------------------------>0,2
\(2Fe+6H_2SO_{4\left(đ\right)}\xrightarrow[]{t^o}Fe_2\left(SO_4\right)_3+3SO_2+6H_2O\)
0,2---------------------------------------->0,3
\(Cu+2H_2SO_{4\left(đ\right)}\xrightarrow[]{t^o}CuSO_4+SO_2+2H_2O\)
0,15<--------------------------------0,15
=> \(\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{0,2.56}{0,2.56+0,15.64}.100\%=53,85\%\\\%m_{Cu}=100\%-53,85\%=46,15\%\end{matrix}\right.\)


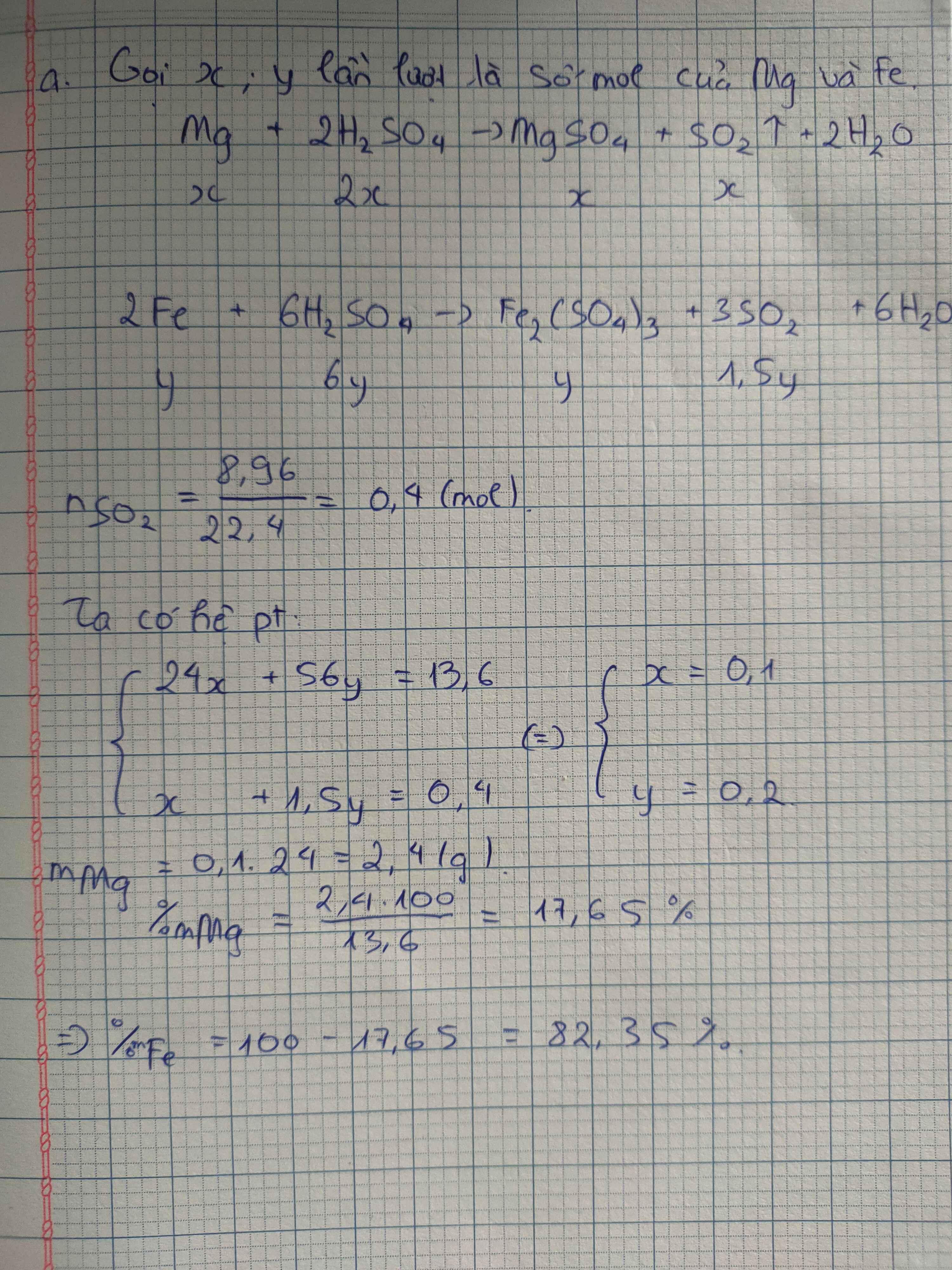

a, \(Cu+2H_2SO_{4\left(đ\right)}\underrightarrow{t^o}CuSO_4+SO_2+2H_2O\)
b, \(n_{SO_2}=\dfrac{3,7185}{24,79}=0,15\left(mol\right)\)
Theo PT: \(n_{Cu}=n_{CuSO_4}=n_{SO_2}=0,15\left(mol\right)\)
\(\Rightarrow m_{Cu}=0,15.64=9,6\left(g\right)=m\)
Theo PT: \(n_{H_2SO_4}=2n_{SO_2}=0,3\left(mol\right)\Rightarrow C\%_{H_2SO_4}=\dfrac{0,3.98}{200}.100\%=14,7\%=x\)
Ta có: m dd sau pư = 9,6 + 200 - 0,15.64 = 200 (g)
\(\Rightarrow C\%_{CuSO_4}=\dfrac{0,15.160}{200}.100\%=12\%\)