Tính% các nguyên tố trong hợp chất K2CO3
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


+ Bước 1: Tính M của hợp chất.
+ Bước 2: Xác định số mol nguyên tử mỗi nguyên tố trong hợp chất.
Ví dụ 1: Xác định thành phần phần trăm theo khối lượng của các nguyên tố có trong hợp chất KNO3
Lời giải
+ MKNO3 = 39_+ 14+16.3=101 gam
+ Trong 1 mol KNO3 có:
1 mol nguyên tử K
1 mol nguyên tử N
3 mol nguyên tử O
+ %K= (39.100):101=36,8%
+ %N= (14.100):101=13,8%
+ %K= (48.100):101=47,6%
Hoặc %O=100%-(36,8%+13,8%)=47,6%
Ví dụ 2: Tính thành phần phần trăm theo khối lượng của các nguyên tố có trong hợp chất Fe2O3
Lời giải
+ MFe2O3 = 56.2+16.3= 160 gam
+ Trong 1 mol Fe2O3 có:
2 mol nguyên tử Fe
3 mol nguyên tử O
+ %Fe = (112.100):160 = 70%
+ %O = (48.100):160 = 30%
Hoặc %O = 100% - 70% = 30%
*bn áp dụng theo cái này nha
Tính phần trăm khối lượng của các nguyên tố trong hợp chất: NaNO3; K2CO3 , Al(OH)3, SO2, SO3, Fe2O3.

\(NaNO_3\\ \%m_{Na}=\dfrac{23}{23+14+3.16}.100\approx27,059\%\\ \%m_N=\dfrac{14}{23+14+3.16}.100\approx16,471\%\\ \%m_O=\dfrac{3.16}{23+14+3.16}.100\approx56,471\%\)
Em tương tự làm cho các chất còn lại!

- \(n_{Fe}=\dfrac{m}{M}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
- \(n_{H_2}=\dfrac{V_{\left(\text{đ}ktc\right)}}{22,4}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
- \(n_{Cu}=\dfrac{3,0115.10^{23}}{6.10^{23}}=0,5\left(mol\right)\)
- K2CO3 \(\left\{{}\begin{matrix}\%K=\dfrac{78}{138}.100\%=56,52\%\\\%C=\dfrac{12}{138}.100\%=8,7\%\\\%O=100\%-56,52\%-8,7\%=34,78\%\end{matrix}\right.\)

\(PTK_{NaNO_3}=23+14+3.16=85\left(đvC\right)\)
\(\%m_{Na}=\dfrac{23}{85}.100=27,05\%\)
\(\%m_N=\dfrac{14}{85}.100=16,47\%\)
\(\%m_O=\dfrac{3.16}{85}=56,47\%\)
\(PTK_{K_2CO_3}=2.39+12+3.16=138\left(đvC\right)\)
\(\%m_K=\dfrac{78}{138}.100=56,52\%\)
\(\%m_C=\dfrac{12}{138}.100=8,69\%\)
\(\%m_O=\dfrac{3.16}{138}.100=34,78\%\)
các ý còn lại làm tương tự
bạn cho mik thêm chỗ này nhé, lúc đấy vội nên mik ghi thiếu
\(\%m_O=\dfrac{3.16}{85}.100=56,47\%\)

Câu 2:
\(CTHH:X_2O_5\\ M_{X_2O_5}=\dfrac{16}{100\%-43,67\%}=142\left(g\text{/}mol\right)\\ \Rightarrow M_X=\dfrac{142-16.5}{2}=31\left(g\text{/}mol\right)\left(P\right)\\ \Rightarrow CTHH:P_2O_5\)
Câu 3:
Trong 1 mol B: \(\left\{{}\begin{matrix}n_{Al}=\dfrac{342.15,79\%}{27}=2\left(mol\right)\\n_S=\dfrac{342.28,07\%}{32}=3\left(mol\right)\\n_O=\dfrac{342-2.27-3.32}{16}=12\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow CTHH_B:Al_2\left(SO_4\right)_3\)
Câu 4:
\(M_X=8,5.2=17\left(g\text{/}mol\right)\)
Trong 1 mol X: \(\left\{{}\begin{matrix}n_N=\dfrac{17.82,35\%}{14}=1\left(mol\right)\\n_H=\dfrac{17.17,65\%}{1}=3\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow CTHH_X:NH_3\)
C1:
\(NaNO3:\)
\(MNaNO3=23+62=\dfrac{85g}{mol}\)
\(\%Na=\dfrac{23.100}{85}=27\%\)
\(\%N=\dfrac{14.100}{85}=16\%\)
\(\%O=\dfrac{16.3.100}{85}=56\%\)
\(K2CO3\)
\(MK2CO3=39.2+60=\dfrac{138g}{mol}\)
\(\%K=\dfrac{39.2.100}{138}=57\%\)
\(\%C=\dfrac{12.100}{138}=9\%\)
\(\%O=\dfrac{16.3.100}{138}=35\%\)
\(Al\left(OH\right)3:\)
\(MAl\left(OH\right)3=27+17.3=\dfrac{78g}{mol}\)
\(\%Al=\dfrac{27.100}{78}=35\%\)
\(\%O=\dfrac{16.3.100}{78}=62\%\)
\(\%H=\dfrac{1.3.100}{78}=4\%\)
\(SO2:\)
\(MSO2=32+16.2=\dfrac{64g}{mol}\)
\(\%S=\dfrac{32.100}{64}=50\%\)
\(\%O=\dfrac{16.2.100}{64}=50\%\)
\(SO3:\)
\(MSO3=32+16.3=\dfrac{80g}{mol}\)
\(\%S=\dfrac{32.100}{80}=40\%\)
\(\%O=\dfrac{16.3.100}{80}=60\%\)
\(Fe2O3:\)
\(MFe2O3=56.2+16.3=\dfrac{160g}{mol}\)
\(\%Fe=\dfrac{56.2.100}{160}=70\%\)
\(\%O=\dfrac{16.3.100}{160}=30\%\)
C5:
a,MX=2,207.29=64đvC
b, gọi cthh của hợp chất này là SxOy
Ta có: 32x:16y=50:50
=>x:y=\(\dfrac{50}{32}:\dfrac{50}{16}\)
= 1,5625:3,125
= 1 : 2
Vậy CTHH của hợp chất này là SO2
C2,3,4 lm r nên t bổ sung thim:>
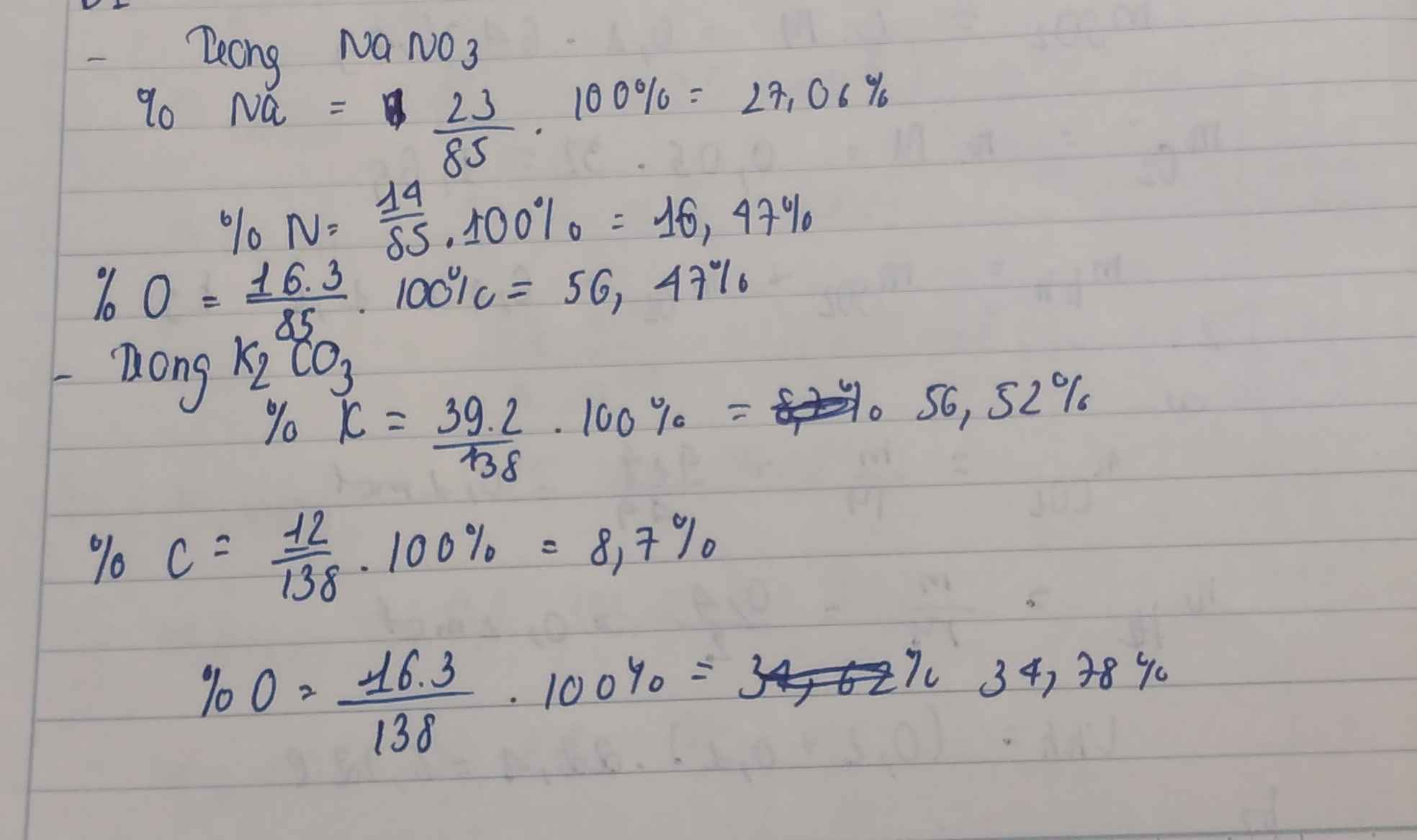
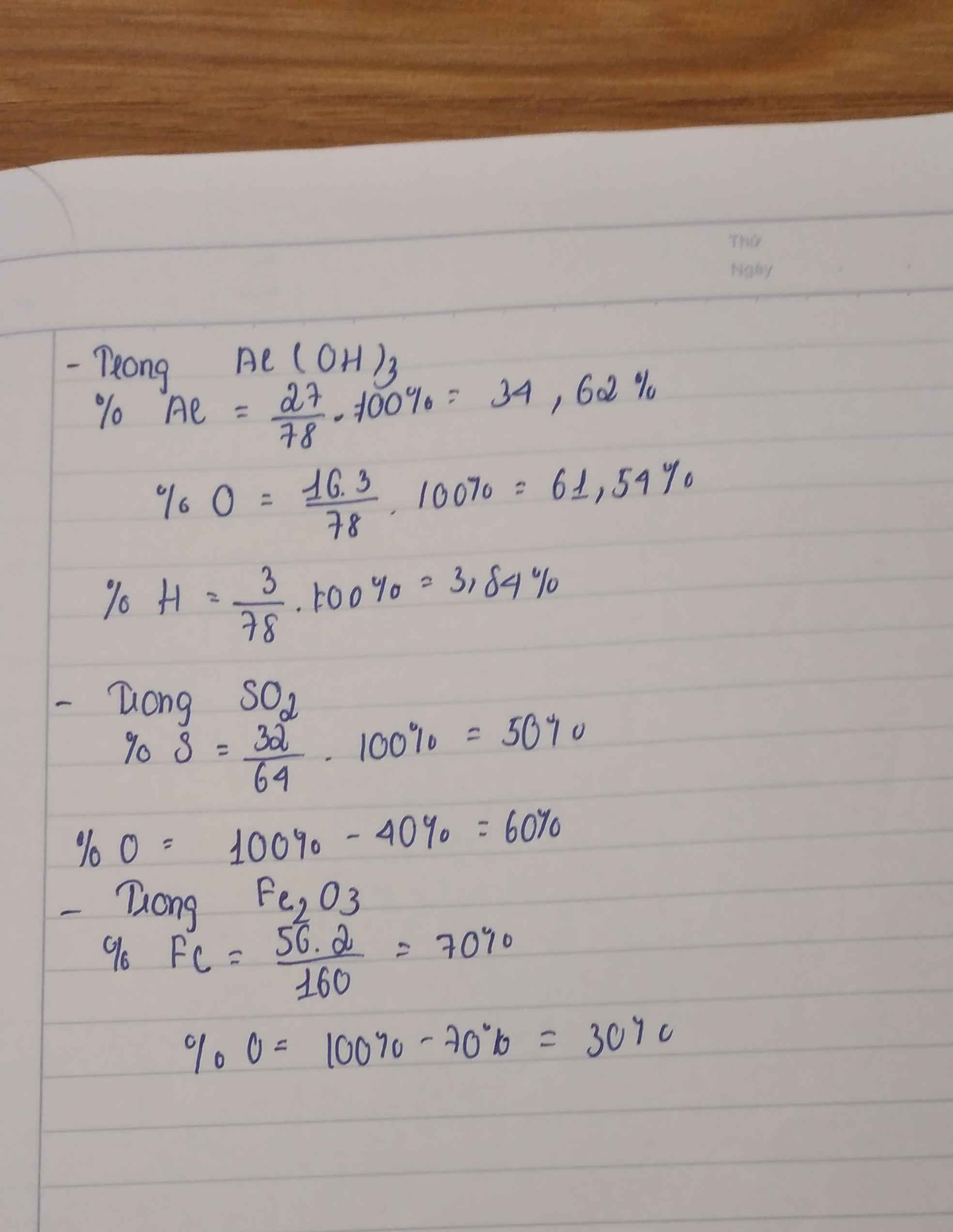
Ta có: MK2CO3 = 39.2 + 12 + 16.3 = 138 (g/mol)
\(\Rightarrow\left\{{}\begin{matrix}\%K=\dfrac{39.2}{138}.100\%\approx56,5\%\\\%C=\dfrac{12}{138}.100\%\approx8,7\%\\\%O\approx34,8\%\end{matrix}\right.\)