Cho hỗn hợp gồm Na,al vào nước dư . Sau phản ứng kết thúc thu được 8,96 l khí ở đktc,m gam rắn,và 400 ml dd A biết nNa:nAl= 1:2 tính m và Cm chất trong A
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Gọi x = nNa
Na + H2O → NaOH + 1 2 H2
x → x → 0,5x
Al + NaOH + H2O → NaAlO2 + 3 2 H2
x ← x → 1,5x
Do sau phản ứng, thu được chất rắn Y nên Al vẫn còn dư ⇒ NaOH hết
Vậy ∑nH2 = 0,5x + 1,5x = 8 , 96 22 , 4 ⇒ x = 0,2
⇒ mNa + mAl pư = 23x + 27x = 10g ⇒ mAl còn dư = 16,75 – 10 = 6,75g ⇒ Chọn A

Đáp án A
Gọi x = nNa
Na + H2O → NaOH + 1 2 H2
x → x → 0,5x
Al + NaOH + H2O → NaAlO2 + 3 2 H2
x ← x → 1,5x
Do sau phản ứng, thu được chất rắn Y nên Al vẫn còn dư NaOH hết
Vậy ∑nH2 = 0,5x + 1,5x = 8 , 96 22 , 4 => x = 0,2
=> mNa + mAl pư = 23x + 27x = 10g => mAl còn dư = 16,75 – 10 = 6,75g

Đáp án A
n H 2 = 8 , 96 22 , 4 = 0 , 4 mol
Gọi số mol Na là a mol => số mol của Al là 2a mol
m gam chất rắn không tan là Al => Al dư sau phản ứng với NaOH
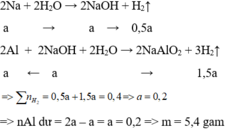

Giải thích:
Gọi số mol của Na và Al lần lượt là x và 2x (mol)
Na + H2O → NaOH + 0,5H2
x x 0,5x
Al + NaOH + H2O → NaAlO2 + 1,5H2
x ← x → x → 1,5x
nH2 = 0,4 => 0,5x + 1,5x = 0,4 => x = 0,2
Chất rắn không tan là Al dư: nAl dư = 2x – x = x = 0,2 mol
=> m = mAl dư = 27.0,2 = 5,4 gam
Đáp án D

Chọn D
Gọi số mol Na là x mol → số mol Al là 2x mol. Theo bài ra chất rắn không tan sau phản ứng là Al dư.

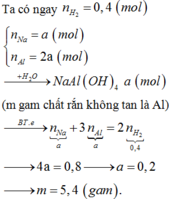

\(n_{H_2}=\dfrac{8,96}{22,4}=0,4mol\\ 2Na+2H_2O\rightarrow2NaOH+H_2\\ n_{Na}=n_{NaOH}=0,4:2=0,2mol\)
ta có \(\dfrac{n_{Na}}{n_{Al}}=\dfrac{1}{2}\)
\(\Rightarrow n_{Al}=2n_{Na}=2.0,2=0,4mol\\ m_{rắn}=m_{Al}=0,4.27=10,8g\)
\(C_M\) \(_A=C_M\) \(_{NaOH}=\dfrac{0,2}{0,4}=0,5M\)
Bạn ơi sau khi tạo thành NaOH thì Al có pư với NaOH mà?