Điều chế ethyl acetate bằng cách cho 6 gam acetic acid tác dụng với 5,2 gam ethanol có xúc tác là dung dịch sulfuric acid đặc và đun nóng thu được 5,28 gam ester. Tính hiệu suất của phản ứng.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(CH_3COOH+C_2H_5OH⇌\left(H^+,t^o\right)CH_3COOC_2H_5+H_2O\\ n_{CH_3COOH}=\dfrac{12}{60}=0,2\left(mol\right);n_{C_2H_5OH}=\dfrac{13,8}{46}=0,3\left(mol\right)\\ Vì:\dfrac{0,3}{1}>\dfrac{0,2}{1}\Rightarrow C_2H_5OH.dư\\ n_{CH_3COOC_2H_5\left(LT\right)}=n_{CH_3COOH}=0,2\left(mol\right)\\ n_{CH_3COOC_2H_5\left(TT\right)}=\dfrac{11}{88}=0,125\left(mol\right)\\ \Rightarrow H=\dfrac{0,125}{0,2}.100\%=62,5\%\)
Ủa em ơi toán giải thì để người khác làm chứ em?

\(n_{CH_3COOH}=\dfrac{12}{60}=0,2\left(mol\right);n_{C_2H_5OH}=\dfrac{12}{46}=\dfrac{6}{23}\left(mol\right)\\ PTHH:CH_3COOH+C_2H_5OH⇌\left(H^+,t^o\right)CH_3COOC_2H_5+H_2O\\ Vì:0,2:1< \dfrac{6}{23}:1\Rightarrow Ethanol.dư\\ n_{este\left(LT\right)}=n_{acid}=0,2\left(mol\right)\\ n_{este\left(TT\right)}=\dfrac{8}{88}=\dfrac{1}{11}\left(mol\right)\\ \Rightarrow H=\dfrac{\dfrac{1}{11}}{0,2}.100\%\approx45,455\%\)

1. Hiện tượng: Phản ứng sinh ra chất lỏng, nhẹ hơn nước, có mùi thơm đặc trưng.
Phương trình hoá học:
\(C_2H_5OH+CH_3COOH⇌\left(H^+,t^o\right)CH_3COOC_2H_5+H_2O\)
2. Sulfuric acid trong thí nghiệm trên vừa là chất xúc tác, vừa có tác dụng hút nước, do đó góp phần làm tăng hiệu suất tạo ester, tăng tốc độ phản ứng.

Đáp án : A
Nếu trong hỗn hợp không có H-CHO thì số mol trong phần 1 là 0,5 mol nên tổng là 1 mol => M trung bình = 20,8 => Loại
Vậy 2 andehit là HCHO (x mol) và CH3-CHO (y mol) (số mol trong hỗn hợp ban đầu)
Lập hệ ta có: 30x + 44y = 20,8 ; (4x + 2y)/2 = 1;
=> x = 0,4 ; y = 0,2
Vậy phần 2 có 0,2 mol HCHO ; 0,1 mol CH3CHO tạo ra 0,1 mol CH3OH và phản ứng 0,1 mol ; 0,1 mol CH3CH2OH và phản ứng x mol.
Số mol H2O = 1/2 tổng số mol ancol.
Bảo toàn khối lượng ta có: 32.0,l + 46.x – 18.(0,1 + x)/2 = 4,52 => x = 0,06
H = 0,06/0,1 = 60%


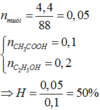


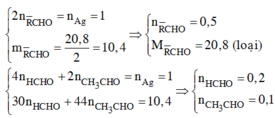
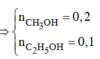
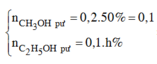
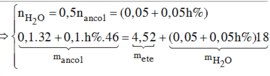
\({{\rm{n}}_{{\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{COOH}}}}{\rm{ = }}\frac{{\rm{6}}}{{{\rm{60}}}}{\rm{ = 0,1 (mol); }}{{\rm{n}}_{{{\rm{C}}_2}{{\rm{H}}_5}{\rm{OH}}}}{\rm{ = }}\frac{{{\rm{5,2}}}}{{46}}{\rm{ }} \approx {\rm{ 0,113 (mol)}}\)
Phương trình hóa học:
Ta có: \(\frac{{0,1}}{1} < \frac{{0,113}}{1}\) => acetic acid hết, ester tính theo acetic acid.
\(\begin{array}{l}{{\rm{n}}_{{\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{COO}}{{\rm{C}}_2}{{\rm{H}}_5}}}{\rm{ = }}{{\rm{n}}_{{\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{COOH}}}}{\rm{ = 0,1 (mol) }}\\ \Rightarrow {{\rm{m}}_{{\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{COO}}{{\rm{C}}_2}{{\rm{H}}_5}}} = {\rm{0,1}} \times {\rm{88 = 8,8 (g)}}\\ \Rightarrow {\rm{H = }}\frac{{5,28}}{{8,8}} \times 100\% = 60\% \end{array}\)