Quan sát hình 4.4, cho biết ở điều kiện chuẩn (áp suất 1 bar và nhiệt độ 25 oC), thể tích 1 mol khí là bao nhiêu.

Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi ρ 1 và ρ 2 là khối lượng riêng của không khí ở nhiệt độ T 1 = 27 + 273 = 300 K và nhiệt độ T 2 là nhiệt độ khi khí cầu bắt đầu bay lên.
Khi khí cầu bay lên:
F Á c - s i - m é t = P v ỏ k h í c ầ u + P c ủ a k h ô n g k h í n ó n g
ρ 1 gV = mg + ρ 2 gV
ρ 2 = ρ 1 – m/V (1)
Ở điều kiện chuẩn, khối lượng riêng của không khí là:
ρ 0 = 29g/22,4l = 1,295g/ d m 3 = 1,295kg/ m 3
Vì thể tích của một lượng khí tỉ lệ thuận với nhiệt độ tuyệt đối khi áp suất không đổi nên khối lượng riêng của một lượng khí tỉ lệ nghịch với nhiệt độ tuyệt đối khi áp suất không đổi.
Ta có: ρ 1 = T 0 ρ 0 / T 1 (2)
Từ (1) và (2) suy ra: ρ 1 = 1,178 kg/ m 3
Do đó ρ 2 = 0,928 kg/ m 3
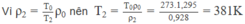
t 2 = 108 ° C
Hãy tính thể tích chất khí ở điều kiện tiêu chuẩn (250C và áp suất 1 bar) có trong 0,6 mol khí Hidro


Điều kiện tiêu chuẩn : nhiệt độ 0oC , áp suất 1 atm.
Thể tích mol phân tử của chất khí là thể tích chứa 6,022.1023 phân tử khí hay 1 mol chất khí.
Ở đktc , thể tích của 1 mol chất khí bằng 22,4 lít.
Người ta quy ước điều kiện thường là ở nht độ 20oC và áp suất 1 atm.
Điều kiện tiêu chuẩn : nhiệt độ 0oC , áp suất 1 atm
Thể tích mol phân tử của chất khí là thể tích chứa 6.1023 phân tử khí hay 1 mol chất khí. -
Ở đktc , thể tích của 1 mol chất khí bằng 22,4 lít.
- Người ta quy ước điều kiện thường là ở nht độ 20oC và áp suất 1 atm.

Ta có: \(\dfrac{p_1\cdot V_1}{T_1}=\dfrac{p_2\cdot V_2}{T_2}\)
\(\Rightarrow\dfrac{20\cdot750}{37+273}=\dfrac{V_2\cdot740}{0+273}\)
\(\Rightarrow V_2=17,85dm^3=17,85l\)
Đổi 20dm3=20000cm3
Áp dụng pt trạng thái:
(P1.V1):T1 = (P2.V2):T2
⇒( 750.20000):310 = (740.V2): 273
⇒V2= 17851 cm3

a) \(n_{Fe}=\dfrac{28}{56}=0,5\left(mol\right)\)
b) \(n_{Al}=\dfrac{13,5}{27}=0,5\left(mol\right)\)
c) \(n_{CO_2}=\dfrac{11}{44}=0,25\left(mol\right)\)
d) \(m_{O_2}=\dfrac{4,958.0,99}{0,082.\left(273+25\right)}=0,2\left(mol\right)\)
e) \(m_{CH_4}=\dfrac{12,359.0,99}{0,082\left(273+25\right)}=0,5\left(mol\right)\)
a: \(n=\dfrac{28}{56}=0.5\left(mol\right)\)
b: \(n=\dfrac{13.5}{27}=0.5\left(mol\right)\)

Ta thấy tỉ lệ về thể tích cùng là tỉ lệ về số mol:
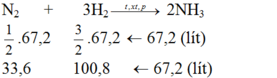
Tỉ lệ số mol cũng chính là tỉ lệ thể tích
Theo pt:
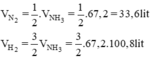
Do hiệu suất của phản ứng là 25% nên thể tích của nitơ và hiđro cần lấy là:
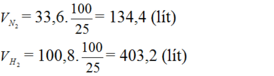
Ở điều kiện chuẩn (áp suất 1 bar và nhiệt độ 25oC), thể tích 1 mol khí là 24,79 lít.
1 mol khí ở đkc (1bar, 25oC) có thể tích 24,79 lít