Cho 34,8 gam MnO2 vào dung dịch HCl đặc, dư thu được khí X. a. Tính thể tích khí X (đktc)? b.Trộn toàn bộ khí X ở trên với 11,2 lít H2(đktc), rồi chiếu sáng đến phản ứng hoàn toàn thì thu được hỗn hợp khí Z. Tính % thể tích mỗi khí trong Z ? c.Hòa tan toàn bộ khí Z (ở ý b) vào nước được 200 gam dung dịch Y. Tính C% của Y? d.Cho toàn bộ khí X hấp thụ vào 500 ml dung dịch NaOH 4M được dung dịch A. Tính nồng độ mol/l các chất trong dung dịch A ? Biết khi hòa tan X vào dung dịch thì không làm thay đổi thể tích.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
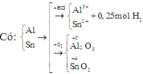
Vì trong hai thí nghiệm số oxi hóa của Sn trong sản phẩm thu được khác nhau nên ta cần tìm số mol cụ thể của mỗi kim loại trong hỗn hợp.
Một số bạn không để ý đến tính chất đặc biệt này của Sn mà cho rằng số oxi hóa của cả hai kim loại trong sản phẩm ở hai thí nghiệm là như nhau nên áp dụng ngay định luật bảo toàn mol electron:
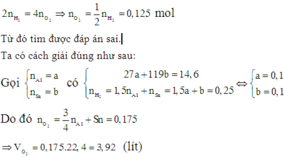

Có V1 < V2 => khi X tác dụng với H2O thì Al còn dư.
Giả sử số mol 3 kim loại là: x, y, z.
K + H2O → KOH + ½ H2↑
x → x 0,5x
Al + KOH + H2O → KAlO2 + 1,5H2↑
x ← x→ 1,5x
→ 0,5x + 1,5x = 0,2 → x = 0,1
X tác dụng với KOH: 0,1 . 0,5 + 1,5y = 0,35 => y = 0,2
Khi cho X tác dụng với H2O còn dư Al => Y chứa Al dư và Fe
nAl dư = nAl ban đầu – nAl phản ứng = 0,2 – 0,1 = 0,1mol
=> 0,1 . 1,5 + z = 0,4 => z = 0,25mol
=> m = 23,3g

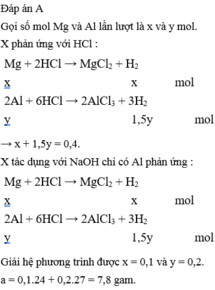
Đáp án A
Gọi số mol Mg và Al lần lượt là x và y mol.
X phản ứng với HCl :
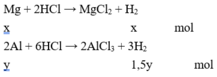
→ x + 1,5y = 0,4.
X tác dụng với NaOH chỉ có Al phản ứng :
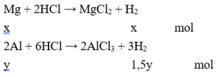
Giải hệ phương trình được x = 0,1 và y = 0,2.
a = 0,1.24 + 0,2.27 = 7,8 gam.








a, \(MnO_2+4HCl\rightarrow MnCl_2+Cl_2+2H_2O\)
Ta có: \(n_{MnO_2}=\dfrac{34,8}{87}=0,4\left(mol\right)\)
Theo PT: \(n_{Cl_2}=n_{MnO_2}=0,4\left(mol\right)\Rightarrow V_{Cl_2}=0,4.22,4=8,96\left(l\right)\)
b, \(n_{H_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
PT: \(Cl_2+H_2\underrightarrow{as}2HCl\)
Xét tỉ lệ: \(\dfrac{0,4}{1}< \dfrac{0,5}{1}\), ta được H2 dư.
Theo PT: \(\left\{{}\begin{matrix}n_{H_2\left(pư\right)}=n_{Cl_2}=0,4\left(mol\right)\\n_{HCl}=2n_{Cl_2}=0,8\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow n_{H_2\left(dư\right)}=0,5-0,4=0,1\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}\%V_{HCl}=\dfrac{0,8.22,4}{\left(0,8+0,1\right).22,4}.100\%\approx88,89\%\\\%V_{H_2\left(dư\right)}\approx11,11\%\end{matrix}\right.\)
c, Ta có: \(m_{HCl}=0,8.36,5=29,2\left(g\right)\)
\(\Rightarrow C\%_{HCl}=\dfrac{29,2}{200}.100\%=14,6\%\)
d, \(n_{NaOH}=0,5.4=2\left(mol\right)\)
PT: \(Cl_2+2NaOH\rightarrow NaCl+NaClO+H_2O\)
Xét tỉ lệ: \(\dfrac{0,4}{1}< \dfrac{2}{2}\), ta được NaOH dư.
Theo PT: \(\left\{{}\begin{matrix}n_{NaCl}=n_{NaClO}=n_{Cl_2}=0,4\left(mol\right)\\n_{NaOH\left(pư\right)}=2n_{Cl_2}=0,8\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow n_{NaOH\left(dư\right)}=2-0,8=1,2\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}C_{M_{NaCl}}=C_{M_{NaClO}}=\dfrac{0,4}{0,5}=0,8\left(M\right)\\C_{M_{NaOH\left(dư\right)}}=\dfrac{1,2}{0,5}=2,4\left(M\right)\end{matrix}\right.\)