Giả sử khi kết thúc chuẩn độ, thể tích dung dịch NaOH (tính trung bình sau 3 lần chuẩn độ) đã sử dụng ở burette là 10,27 mL. Tính nồng độ của dung dịch NaOH.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


VHCl = 10 (mL); CHCl = 0,1 (M); VNaOH = 12,5 (mL)
\( \Rightarrow {{\rm{C}}_{{\rm{NaOH}}}}{\rm{ = }}\frac{{{{\rm{V}}_{{\rm{HCl}}}}{\rm{.}}{{\rm{C}}_{{\rm{HCl}}}}}}{{{{\rm{V}}_{{\rm{NaOH}}}}}}{\rm{ = }}\frac{{{\rm{10}}{\rm{.0}}{\rm{,1}}}}{{{\rm{12}}{\rm{,5}}}}{\rm{ = 0}}{\rm{,08 (M)}}\)

nNa= 4,6/23=0,2(mol)
PTHH: Na + H2O ->NaOH + 1/2 H2
nNaOH=nNa=0,2(mol)
VddNaOH=V(H2O)= 100(ml)=0,1(l)
=> CMddNaOH= 0,2/0,1= 2(M)

PTHH: Na + H2O -> NaOH + 1/2 H2
a) nNa= 4,6/23= 0,2(mol) -> nNaOH=0,2(mol); nH2=0,1(mol)
V(H2,đktc)=0,1.22,4=2,24(l)
=> CMddNaOH= 0,2/0,1=2(M)
b) nNa= 4,6/23= 0,2(mol) -> nNaOH=0,2(mol); nH2=0,1(mol)
=>V(H2,đktc)=0,1.22,4=2,24(l)
CMddNaOH= 0,2/0,05=4(M)
a) Số mol của natri
nNa = \(\dfrac{m_{Na}}{M_{Na}}=\dfrac{4,6}{23}=0,2\left(mol\right)\)
Pt : 2Na + 2H2O → 2NaOH + H2\(|\)
2 2 2 1
0,2 0,2 0,1
Số mol của khí hidro
nH2 = \(\dfrac{0,2.1}{2}=0,1\left(mol\right)\)
Thể tích của khí hidro ở dktc
VH2 = nH2 . 22,4
= 0,1 . 22,4
= 2,24 (l)
Số mol của dung dịch natri hidroxit
nNaOH = \(\dfrac{0,1.2}{1}=0,2\left(mol\right)\)
100ml = 0,1l
Nồng độ mol của dung dịch natri hidroxit
CMNaOH = \(\dfrac{n}{V}=\dfrac{0,2}{0,1}=2\left(M\right)\)
b) Số mol của natri
nNa = \(\dfrac{m_{Na}}{M_{Na}}=\dfrac{4,6}{23}=0,2\left(mol\right)\)
Pt : 2Na + 2H2O → 2NaOH + H2\(|\)
2 2 2 1
0,2 0,2 0,1
Số mol của khí hidro
nH2 = \(\dfrac{0,2.1}{2}=0,1\left(mol\right)\)
Thể tích của khí hidro ở dktc
VH2 = nH2 . 22,4
= 0,1 .22,4
= 2,24 (l)
Số mol của dung dịch natri hidroxit
nNaOH = \(\dfrac{0,1.2}{1}=0,2\left(mol\right)\)
50ml = 0,05l
Nồng độ mol của dung dịch natri hidroxit
CMNaOH = \(\dfrac{n}{V}=\dfrac{0,2}{0,05}=4\left(M\right)\)
Chúc bạn học tốt

\(a,2NaOH+MgSO_4\rightarrow Mg\left(OH\right)_2+Na_2SO_4\\ n_{NaOH}=0,5.1=0,5\left(mol\right)\\ b,n_{Mg\left(OH\right)_2}=\dfrac{0,5}{2}=0,25\left(mol\right)=n_{Na_2SO_4}\\ m_{kt}=m_{Mg\left(OH\right)_2}=58.0,25=14,5\left(g\right)\\ c,V_{ddX}=V_{ddNaOH}+V_{ddMgSO_4}=0,5+0,5=1\left(l\right)\\ C_{MddNa_2SO_4}=\dfrac{0,25}{1}=0,25\left(M\right)\)


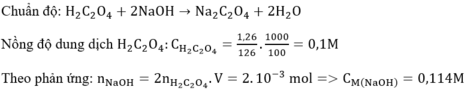
\(NaOH+HCl\rightarrow NaCl+H_2O\\ V_{HCl}.C_{HCl}=V_{NaOH}.C_{NaOH}\\ \Rightarrow C_{NaOH}=\dfrac{V_{HCl}}{V_{NaOH}}.C_{HCl}=\dfrac{10}{10,27}.0,1\approx0,097\left(M\right)\)