Hỗn hợp X gồm N2 và H2 có \(\overline{M_x}=12,4\). Dẫn X đi qua bình đựng bột Fe rồi nung nóng ( hiệu suất tổng hợp NH3 đạt 40%) thu được hỗn hợp Y. \(\overline{M_y}\) có giá trị là
( không giải phương pháp giải bằng sơ đồ đường chéo nha mọi người ! )


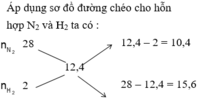
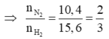



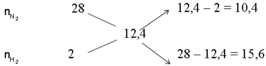

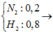
Gọi \(\left\{{}\begin{matrix}n_{N_2}=x\left(mol\right)\\n_{H_2}=y\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\dfrac{28x+2y}{x+y}=12,4\)
\(\Leftrightarrow12,4x+12,4y-28x-2y=0\Leftrightarrow-15,6x=-10,4y\\ \Leftrightarrow\dfrac{x}{y}=-\dfrac{10,4}{-15,6}=\dfrac{2}{3}\)
Giả sử \(\left\{{}\begin{matrix}n_{N_2}=2\left(mol\right)\\n_{H_2}=3\left(mol\right)\end{matrix}\right.\)
\(n_{khí.giảm}=n_{NH_3}=\dfrac{2}{3}n_{H_2}.H\%=\dfrac{2}{3}.3.40\%=0,8\left(mol\right)\)
\(n_Y=2+3-0,8=4,2\left(mol\right)\)
\(m_Y=m_X=28.2+2.3=62\left(g\right)\)
\(\overline{M_Y}=\dfrac{62}{4,2}=14,76g/mol\)
\(n_{N_2}=a;n_{H_2}=b\\ PT:\dfrac{1}{2}N_2+\dfrac{3}{2}H_2-Fe,t^{^0}->NH_3\\ M_X=\dfrac{28a+2b}{a+b}=12,4\\ a=1,5b\\ Sau.pư:\\ M_Y=\dfrac{2.0,6b+28\left(a-\dfrac{0,4b}{3}\right)+17.0,4b}{0,6b+a-\dfrac{0,4b}{3}+0,4b}=19,55\)