cho 3,2g kim loại copper tác dụng với dung dịch silver nitrate agno3 thu đc muối copper (ll) nitrate vf a gm chất rắn
a/ lập phương trình hóa hc
b/ tính khối lượng muối tạo thành
c/ tính a
d/ tính thể tính dung dịch silver nitrate agno3 0,5M đã tham gia phản ứng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(Mg+2HCl\rightarrow MgCl_2+H_2\)
0,05 -->0,1----->0,05----->0,05
b
\(n_{Mg}=\dfrac{1,2}{24}=0,05\left(mol\right)\)
\(m_{MgCl_2}=0,05.95=4,75\left(g\right)\)
c
\(V_{H_2}=0,05.24,79=1,2395\left(l\right)\)
d
\(V_{HCl}=\dfrac{0,1}{2}=0,05\left(l\right)\)

\(a.2Al+6HCl->2AlCl_3+3H_2\\ b.m_{AlCl_3}=\dfrac{1}{3}.0,1.0,6.133,5=2,67g\\ c.V_{H_2}=\dfrac{1}{2}.0,06.24,79=0,7437\left(L\right)\\ d.a=\dfrac{1}{3}.0,1.0,6.27=0,54g\)

\(a/Fe+2HCl\xrightarrow[]{}FeCl_2+H_2\\ b/n_{H_2}=n_{FeCl_2}=0,1mol\\ m_{FeCl_2}=0,1.127=12,7\left(g\right)\\ c/V_{H_2}=0,1.22,4=2,24\left(l\right)\\ d/n_{HCl}=0,1.2=0,2\left(mol\right)\\ V_{HCl\left(pư\right)}=\dfrac{0,2}{2}=0,1\left(l\right)\)
\(c,V_{H_2}=0,1.22,4=2,24\left(l\right)\)
Còn lại giống câu dưới nha

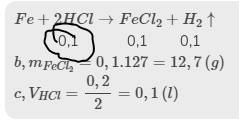
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
0,2 0,1 0,1
\(b,m_{FeCl_2}=0,1.127=12,7\left(g\right)\)
\(c,V_{HCl}=\dfrac{0,2}{2}=0,1\left(l\right)\)

Theo gt ta có: \(n_{Cu}=\dfrac{12,8}{64}=0,2\left(mol\right)\)
\(1Bar=0,9869atm\)
PTHH: \(2Cu+O_2\rightarrow2CuO\)
Ta có: \(n_{CuO}=n_{Cu}=0,2\left(mol\right)\Rightarrow a=m_{CuO}=16\left(g\right)\)
\(n_{O_2}=\dfrac{1}{2}.n_{Cu}=0,1\left(mol\right)\Rightarrow V=\dfrac{n.R.T}{p}=\dfrac{0,1.\dfrac{22,4}{273}.\left(273+20\right)}{0,9869}=2,436\left(l\right)\)

a)
$AgNO_3 + HCl \to AgCl + HNO_3$
Theo PTHH :
$n_{AgCl} = n_{HCl} = n_{AgNO_3} = \dfrac{340.10\%}{170} =0,2(mol)$
$m_{dd\ HCl} = \dfrac{0,2.36,5}{7,3\%} = 100(gam)$
b)
$m_{AgCl} = 0,2.143,5 = 28,7(gam)$
c)
$m_{dd\ sau\ pư} = 340 + 100 -28,7 = 411,3(gam)$
$n_{HNO_3} = n_{AgNO_3} = 0,2(mol)$
$\Rightarrow C\%_{HNO_3} = \dfrac{0,2.63}{411,3}.100\% = 3,06\%$

\(a/2Al+6HCl\xrightarrow[]{}2AlCl_3+3H_2\\ b/n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\\ n_{AlCl_3}=n_{Al}=0,2mol\\ m_{AlCl_3}=0,2.133,5=26,7\left(g\right)\\ c/higro\Rightarrow hydrogen\\ n_{H_2}=\dfrac{0,2.3}{2}=0,3\left(mol\right)\\ V_{H_2}=0,3.24,79=7,437\left(l\right)\\ d/n_{HCl}=\dfrac{0,2.6}{2}=0,6\left(mol\right)\\ V_{HCl}=\dfrac{0,6}{2}=0,3\left(l\right)\)
a
\(Cu+2AgNO_3\rightarrow Cu\left(NO_3\right)_2+2Ag\downarrow\)
0,05 --> 0,1-----------> 0,05------>0,1
b
\(n_{Cu}=\dfrac{3,2}{64}=0,05\left(mol\right)\)
\(m_{Cu\left(NO_3\right)_2}=0,05.188=9,4\left(g\right)\)
c
\(a=m_{Ag}=108.0,1=10,8\left(g\right)\)
d
\(V_{AgNO_3}=\dfrac{0,1}{0,5}=0,2\left(l\right)\)