trong 1 nguyên tử của nguyên tố x có tổng số hạt proton,neutron,electron là 60, số khối của x<41.xác định số hiệu nguyên tử của x
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Trong nguyên tử của nguyên tố X có tổng số hạt proton, neutron, electrong là 60:
\(p_X+e_X+n_X=2p_X+n_X=60\left(1\right)\)
Số khối của x < 41 có:
\(p_X+n_X< 41\)
\(\Rightarrow n_X< 41-p_X\left(2\right)\)
Thế (2) vào (1): \(2p_X+41-p_X< 60\)
\(\Leftrightarrow p_X< 19\) (như này thì số hiệu nguyên tử của X nhiều, bạn xem lại đề rồi nói mình nhé: )

Gọi p là số proton
Gọi n là số nơ tron
Gọi e là số electron
Theo đề bài ta có :
p+n+e=58 và p+n<40
Ta thấy p+n=39<40 (số khối hay Khối lượng nguyên tử) ⇒ n=58-39=19 electron (lớp 1 : 2 electron; lớp 2 : 8 electron; lớp 3: 8 electron; lớp 4 : 1 electron)
⇒ Nguyên tử đó có 4 lớp electron và lớp ngoài cùng có 1 electron ⇒ Thuộc chu kỳ 4 và Nhóm IA
Vậy nguyên tử đó là K (Protassium) và số hiệu nguyên tử là 19

\(2p+n=52\\ n-e=n-p=1\\ p=\dfrac{51}{3}=17\\ n=52-34=18\\ A_X=17+18=35\)

Nguyên tử của nguyên tố X có tổng số hạt proton, neutron, electron là 52 có:
\(p+e+n=2p+n=52\left(1\right)\)
Số hạt không mang điện hơn số hạt mang điện âm là 1 hạt trong nguyên tử của nguyên tố X, có:
\(n-e=1\\ \Leftrightarrow n-p=1\\ \Leftrightarrow-p+n=1\left(2\right)\)
Từ (1), (2) giải được: \(\left\{{}\begin{matrix}p=17\\n=18\end{matrix}\right.\)
Vậy số khối của nguyên tử X là: \(p+n=17+18=35\)

Sửa đề: P ≤ N ≤ 1,33P → P ≤ N ≤ 1,5P (Đây là điều kiện bền của nguyên tử bạn nhé.)
Ta có: P + N + E = 10
Mà: P = E (Do nguyên tử trung hòa về điện.)
⇒ 2P + N = 10 ⇒ N = 10 - 2P
Có: P ≤ N ≤ 1,5P
⇒ P ≤ 10 - 2P ≤ 1,5P
⇒ 2,85 ≤ P ≤ 3,33
⇒ P = E = 3, N = 4
⇒ A = 3 + 4 = 7

`#3107.101107`
a.
Gọi số hạt proton, neutron, electron trong nguyên tử X lần lượt là `p, n, e`
Tổng số hạt trong nguyên tử X là `48`
`=> p + n + e = 48`
Mà trong nguyên tử, số `p = e`
`=> 2p + n = 48`
Mà số hạt `p = n`
`=> 3p = 48`
`=> p = 48 \div 3`
`=> p = 16`
Vậy, số `p = n = e = 16`
b.
Khối lượng nguyên tử X là: `16 + 16 = 32` (amu)
c.
Bạn tham khảo mô hình NT X:
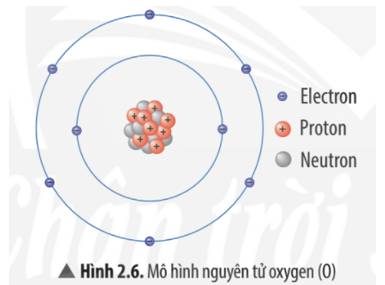
- X có `3` lớp electron
- X có `6` electron lớp ngoài cùng.

Từ đề ra:
\(p+n+e=2p+n=28\\ n=0,53714.28=15\\ p=\dfrac{28-15}{2}=\dfrac{13}{2}\)
p = 6,5 là vô lý nên không có giá trị nào thoả mãn với X.
Gọi p là số proton
Gọi n là số nơ tron
Gọi e là số electron
Theo đề bài ta có :
p+n+e=60 và p+n<41
Ta thấy p+n=40<41 (số khối hay Khối lượng nguyên tử) ⇒ n=60-40=20 electron (lớp 1 : 2 electron; lớp 2 : 8 electron; lớp 3: 8 electron; lớp 4 : 2 electron)
⇒ Nguyên tử đó có 4 lớp electron và lớp ngoài cùng có 2 electron ⇒ Thuộc chu kỳ 4 và Nhóm IIA
Vậy nguyên tử đó là Ca (Calcium) và số hiệu nguyên tử là 20