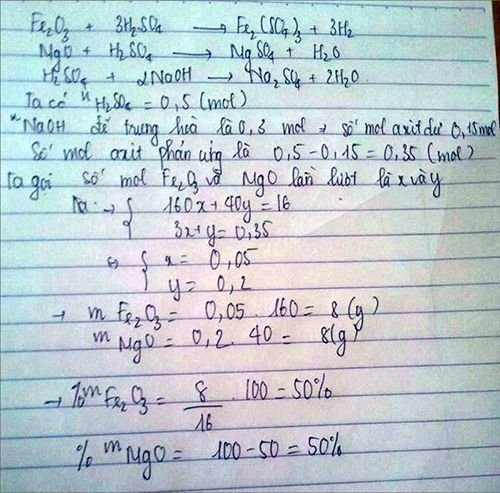Lấy 16g hh MgO và Fe2O3 tan hết trong 0,5 l dd H2SO4 1M sau pu để trung hoà axit còn dư bằng 50g dd NaOH tính % klg mỗi axit trong hh
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Fe2O3 + 6HCl \(\rightarrow\)2FeCl3 + 3H2O (1)
MgO + 2HCl \(\rightarrow\)MgCl2 + H2O (2)
Ca(OH)2 + 2HCl \(\rightarrow\)CaCl2 + 2H2O (3)
nCa(OH)2=\(\dfrac{50.14,8\%}{74}=0,1\left(mol\right)\)
Theo PTHH 3 ta có:
nCa(OH)2=nCaCl2=0,1(mol)
2nCa(OH)2=nHCl=0,2(mol)
mCaCl2=111.0,1=11,1(g)
mmuối của Mg,Fe=46,35-11,1=35,25(g)
Đặt nFe2O3=a
nMgO=b
Ta có:
\(\left\{{}\begin{matrix}160a+40b=16\\325a+95b=35,25\end{matrix}\right.\)
=>a=0,05;b=0,2
mFe2O3=160.0,05=8(g)
%mFe2O3=\(\dfrac{8}{16}.100\%=50\%\)
%mMgO=100-50=50%
Từ 1 ta có:
6nFe2O3=nHCl(1)=0,3(mol)
2nMgO=nHCl=0,2(mol)
=>\(\sum\)nHCl=0,3+0,2+0,2=0,7(mol)
CM dd HCl=\(\dfrac{0,7}{0,3}=\dfrac{7}{3}M\)

a) MgO + 2HCl → MgCl2 + H2O (1)
Fe2O3 + 6HCl → 2FeCl3 + 3H2O (2)
\(n_{Ca\left(OH\right)_2}=\frac{14,8\%.50}{40+17.2}=0,1\left(mol\right)\)
2HCldư + Ca(OH)2 → CaCl2 + 2H2O
0,2 0,1 0,1
\(m_{CaCl_2}=0,1.\left(40+35,5.2\right)=11,1\left(g\right)\)
⇒\(m_{FeCl_3}\) \(_{và}\) \(_{MgCl_2}\) = \(46,35-11,1=35,25\left(g\right)\)
gọi x, y lần lượt là số mol của Fe2O3 và MgO
theo pthh (1) và (2) thì
\(n_{MgCl_2}=n_{MgO}=y\)
\(n_{FeCl_3}=2n_{Fe_2O_3}=2x\)
ta có phương trình \(\left\{{}\begin{matrix}160x+40y=16\\325x+95y=35,25\end{matrix}\right.\)
⇒ x = 0,05; y = 0,2
⇒ \(\%m_{Fe_2O_3}=\frac{0,05.160}{16}.100=50\%\)
⇒ \(\%m_{MgO}=50\%\)
b) nHCl = 6x + 2y + 0,2 = 0,9 (mol)
⇒ C%HCl = \(\frac{0,9}{0,3}=3\left(M\right)\)
\(n_{Fe_2O_3}=x;n_{MgO}=y\\ PTHH:Fe_2O_3+6HCl\rightarrow2FeCl_3+3H_2\\ PTHH:MgO+2HCl\rightarrow MgCl_2+H_2O\\PTHH:2HCl+Ca\left(OH\right)_2\rightarrow CaCl_2+2H_2O\\ \)
\(n_{Ca\left(OH\right)_2}=\frac{50.14,8}{100.74}=0,1\left(mol\right)\\ \rightarrow n_{HCl.du}=0,1.2=0,2\left(mol\right)\\ \rightarrow m_{CaCl_2}=0,1.111=11,1\left(g\right)\\ \rightarrow325x+95y+11,1=46,35\\ \Leftrightarrow325x+95y=46,35-11,1=35,25\)
\(hpt:\left\{{}\begin{matrix}160x+40y=16\\325x+95y=35,25\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,05\\y=0,2\end{matrix}\right.\)
\(\left\{{}\begin{matrix}\%m_{Fe_2O_3}=\frac{160.0,05}{16}.100\%=50\%\\\%m_{MgO}=100-50=50\%\\\sum n_{HCl}=6x+2y+0,2=0,9\left(mol\right)\rightarrow C_M=\frac{0,9}{0,3}=3\left(M\right)\end{matrix}\right.\)