Cho 6,5 gam kẽm vào 200ml dung dịch 1M. Hỏi chất nào dư sau phản ứng và dư bao nhiêu gam?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a) \(n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\)
\(n_{H_2SO_4}=1.0,2=0,2\left(mol\right)\)
PTHH: Zn + H2SO4 --> ZnSO4 + H2
Xét tỉ lệ: \(\dfrac{0,1}{1}< \dfrac{0,2}{1}\) => Zn hết, H2SO4 dư
b)
PTHH: Zn + H2SO4 --> ZnSO4 + H2
0,1--->0,1------->0,1
=> \(m_{ZnSO_4}=0,1.161=16,1\left(g\right)\)
c) \(\left\{{}\begin{matrix}C_{M\left(H_2SO_4.dư\right)}=\dfrac{0,2-0,1}{0,2}=0,5M\\C_{M\left(ZnSO_4\right)}=\dfrac{0,1}{0,2}=0,5M\end{matrix}\right.\)

"Đề bài thiều nồng độ phần trăm của HCl trong dung dịch"
\(Zn + 2HCl \to ZnCl_2 + H_2\\ n_{H_2} = n_{Zn} = \dfrac{6,5}{65} = 0,1(mol)\\ \Rightarrow V_{H_2} = 0,1.22,4 = 2,24(lít)\)

\(n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right);n_{HCl}=0,5.1=0,5\left(mol\right)\\ PTHH:Zn+2HCl\rightarrow ZnCl_2+H_2\\ Vì:\dfrac{0,5}{2}>\dfrac{0,1}{1}\Rightarrow Zn.hết,HCldư\\ n_{HCl\left(dư\right)}=0,5-2.0,1=0,3\left(mol\right)\\ m_{HCl\left(dư\right)}=0,3.36,5=10,95\left(g\right)\)

1.
nAl=\(\dfrac{5,4}{27}\)=0,2 mol
mHCl=\(\dfrac{175.14,6}{100}\)=25,55g
nHCl=\(\dfrac{25,55}{36,5}\)=0,7
2Al + 6HCl → 2AlCl3 + 3H2↑
n trước pứ 0,2 0,7
n pứ 0,2 →0,6 → 0,2 → 0,3 mol
n sau pứ hết dư 0,1
Sau pứ HCl dư.
mHCl (dư)= 36,5.0,1=3,65g
mcác chất sau pư= 5,4 +175 - 0,3.2= 179,8g
mAlCl3= 133,5.0,2=26,7g
C%ddHCl (dư)= \(\dfrac{3,65.100}{179,8}=2,03%\)%
C%ddAlCl3 = \(\dfrac{26,7.100}{179,8}\)= 14,85%
2.
200ml= 0,2l
mMg= \(\dfrac{4,2}{24}=0,175mol\)
Mg + 2HCl → MgCl2 + H2↑
0,175→ 0,35 → 0,175→0,175 mol
a) VH2= 0,175.22,4=3,92l.
b)C%dHCl= \(\dfrac{0,35}{0,2}=1,75\)M

PTHH: \(Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\)
Ta có: \(\left\{{}\begin{matrix}n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\\n_{HCl}=0,25\left(mol\right)\end{matrix}\right.\)
Xét tỉ lệ: \(\dfrac{0,1}{1}< \dfrac{0,25}{2}\) \(\Rightarrow\) HCl còn dư, Kẽm p/ứ hết
\(\Rightarrow\left\{{}\begin{matrix}n_{H_2}=0,1\left(mol\right)\\n_{HCl\left(dư\right)}=0,05\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}V_{H_2}=22,4\cdot0,1=2,24\left(l\right)\\m_{HCl\left(dư\right)}=0,05\cdot36,5=1,825\left(g\right)\end{matrix}\right.\)

PT: \(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
a, Ta có: \(n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\)
\(n_{H_2SO_4}=0,2.1=0,2\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,1}{1}< \dfrac{0,2}{1}\). ta được H2SO4 dư.
Theo PT: \(n_{H_2SO_4\left(pư\right)}=n_{ZnSO_4}=n_{Zn}=0,1\left(mol\right)\)
\(\Rightarrow n_{H_2SO_4\left(dư\right)}=0,2-0,1=0,1\left(mol\right)\)
b, Ta có: \(m_{ZnSO_4}=0,1.161=16,1\left(g\right)\)
c, \(C_{M_{H_2SO_4\left(dư\right)}}=\dfrac{0,1}{0,2}=0,5M\)
\(C_{M_{ZnSO_4}}=\dfrac{0,1}{0,2}=0,5M\)
Bạn tham khảo nhé!

nZn=19,5/65=0,3(mol)
mHCl=18,25/36,5=0,5(mol)
pt: Zn+2HCl--->ZnCl2+H2
1______2
0,3_____0,5
Ta có: 0,3/1>0,5/2
=>Zn dư
mZn dư=0,05.65=3,25(mol)
Theo pt: nH2=1/2nHCl=1/2.0,5=0,25(mol)
=>VH2=0,25.22,4=5,6(l)
nZn = 0,3 mol
nHCl = 0,5 mol
Zn + 2HCl → ZnCl2 + H2
Đặt tỉ lệ ta có
0,3 < \(\dfrac{0,52}{2}\)
⇒ Zn dư và dư 3,25 gam
⇒ VH2 = 0,25.22,4 = 5,6 (l)
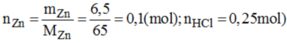
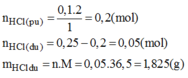
Giải chi tiết giúp mình ạ
Đề cho 200 ml dung dịch gì bạn nhỉ?