Đốt cháy hoàn toàn một lượng khí hidro thu được 18g nước. Tính thể tích khí hidro đã bị đốt cháy ở đktc Giúp tớ vs ạ tớ đang cần để mai kiểm tra 🫰
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a)\(n_{H_2}=\dfrac{8,96}{22,4}=0,4mol\)
\(2H_2+O_2\underrightarrow{t^o}2H_2O\)
0,4 0,2 0,4
\(V_{O_2}=0,2\cdot22,4=4,48l\)
\(V_{kk}=5V_{O_2}=5\cdot4,48=22,4l\)
b)\(CuO+H_2\rightarrow Cu+H_2O\)
0,4 0,4
\(m_{H_2O}=0,4\cdot18=7,2g\)

\(n_{H_2}=\dfrac{V_{H_2}}{22,4}=\dfrac{4,48}{22,4}=0,2mol\)
\(2H_2+O_2\rightarrow2H_2O\)
0,2 0,1 0,2 ( mol )
\(V_{kk}=\dfrac{V_{O_2}.100}{20}=\dfrac{\left(0,1.22,4\right).100}{20}=\dfrac{2,24.100}{20}=11,2l\)
\(m_{H_2O}=n_{H_2O}.M_{H_2O}=0,2.18=3,6g\)
nH2 = 4,48/22,4 = 0,2 (mol)
PTHH: 2H2 + O2 -> (t°) 2H2O
Mol: 0,2 ---> 0,1 ---> 0,2
Vkk = 0,1 . 22,4 . 5 = 11,2 (l)
mH2O = 0,2 . 18 = 3,6 (g)

2H2+O2-to>2H2O
0,2----0,1-----0,2
n H2=0,2 mol
=>m H2O=0,2.18=3,6g
=>Vkk=0,1.22,4.5=11.2l
a, \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH: 2H2 + O2 ----to----> 2H2O
Mol: 0,2 0,1 0,2
\(m_{H_2O}=0,2.18=3,6\left(g\right)\)
b, \(V_{O_2}=0,1.22,4=2,24\left(l\right)\Rightarrow V_{kk}=2,24.5=11,2\left(l\right)\)

Đáp án A
Hỗn hợp khí gồm CH4, C2H6 và C3H8 là các hidrocacbon.
Mà khi đốt cháy 1 hidrocacbon bất kì ta luôn có:
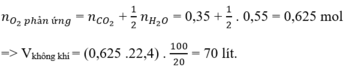

\(n_{H_2O}=\dfrac{18}{18}=1\left(mol\right)\\ PTHH:2H_2+O_2\xrightarrow[]{t^0}2H_2O\\ n_{H_2}=n_{H_2O}=1mol\\ V_{H_2O}=1.22,4=22,4\left(l\right)\)