1:Nêu tính chất hóa học của H2O; tính chất hóa học của H2 và Viết phương trình phản ứng minh họa? 7:Cho 2,4 gam Mg tác dụng hết với 100 gam dung dịch H2SO4, tạo thành Magie sunfat và khí Hiđrô. a) Viết phương trình phản ứng xãy ra. b) Tính thể tích khí thoát ra ở ĐKTC? c) Tính nồng độ phần trăm của dung dịch H2SO4? Giúp nốt mik 2 câu này với ạ
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Mình nghĩ cái này thuộc kiến thức cơ bản, bạn nên tự học trong SGK thì hơn là đi đăng câu hỏi ở Hoc24

nC = 0,2 (mol)
nH = 0,1 . 2 = 0,2 (mol)
nO = 0,25 . 2 - 0,2 . 2 + 0,1 = 0 (mol)
Vậy B chỉ có C và H
CTPT: CxHy
=> x : y = 0,2 : 0,2 = 1 : 1
=> (CH)n = 22,4/1 . 1,161 = 26 (g/mol(
=> n = 2
=> CTPT: C2H2
Là một chất khí không màu, không mùi, dễ bắt cháy và nhẹ hơn không khí. Nó không tồn tại ở dạng tinh khiết hoàn toàn mà thường được để trong một dung dịch do tính không ổn định ở dạng tinh khiết. Là chất ít tan trong nước. (tham khảo)

Câu 1 :
+ Làm đổi màu chất chỉ thị màu : làm quỳ tím hóa đỏ
+ Tác dụng với kim loại :
vd : \(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
+ Tác dụng với oxit bazo :
vd : \(2NaOH+SO_2\rightarrow Na_2SO_3+H_2O\)
\(BaO+H_2SO_4\rightarrow BaSO_4+H_2\)
+ Tác dụng với bazo :
vd : \(2NaOH+H_2SO_4\rightarrow Na_2SO_4+2H_2O\)
\(KOH+HCl\rightarrow KCl+H_2O\)
Chúc bạn học tốt
Câu 2 :
+ Làm đổi màu chất chỉ thị màu : làm quỳ tím hóa xanh
+ Tác dụng với oxit axit :
vd : \(2NaOH+SO_2\rightarrow Na_2SO_3+H_2O\)
\(2KOH+CO_2\rightarrow K_2CO_3+H_2O\)
+ Tác dụng với axit :
vd : \(NaOH+HCl\rightarrow NaCl+H_2O\)
\(Ba\left(OH\right)_2+H_2SO_4\rightarrow BaSO_4+2H_2O\)
+ Bazo không tan bị nhiệt phân hủy :
vd : \(Zn\left(OH\right)_2\rightarrow\left(t_o\right)ZnO+H_2O\)
\(2Fe\left(OH\right)_3\rightarrow\left(t_o\right)Fe_2O_3+3H_2O\)
Chúc bạn học tốt

-Sự đa dạng của chất:
+Những gì tồn tại xung quanh ta gọi là vật thể.
+Mỗi vật thể được tạo nên từ 1 hay nhiều chất.
-Tính chất vật lý:trạng thái (rắn,lỏng,khí),màu,mùi vị,tan hay không tan trong nước,nhiệt độ nóng chảy,nhiệt đọ sôi,khối lượng riêng,tính dẫn điện,dẫn nhiệt,....
-Tính chất hóa học:là sự biến đổi từ chất này thành chất khác.

Tham khảo:
Câu 1:
Khí oxi là một đơn chất phi kim rất hoạt động, đặc biệt ở nhiệt độ cao, dễ dàng tham gia phản ứng hóa học với nhiều phi kim, nhiều kim loại và hợp chất. Trong các hợp chất hóa học, nguyên tố oxi có hóa trị II.
Cụ thể:
- Tác dụng với kim loại: O2 oxi hóa được hầu hết các kim loại trừ Ag, Au, Pt.
Ví dụ:
- Tác dụng với hiđro, phản ứng có thể gây nổ mạnh nếu tỉ lệ thể tích O2 : H2 = 1:2
Phương trình hóa học:
- Tác dụng với một số phi kim khác:
Ví dụ:
+ Tác dụng với một số hợp chất:
Ví dụ:

Bài 2:
\(m_{HF}=\dfrac{2,5.40\%}{100\%}=1(kg)\\ \Rightarrow n_{HF}=\dfrac{1}{20}=0,05(kmol)\\ PTHH:CaF+H_2SO_4\to CaSO_4+2HF\\ \Rightarrow n_{CaF}=0,025(kmol)\\ \Rightarrow m_{CaF}=0,025.78=1,95(kg)\)
Bài 3:
\(a,\) Đặt \(\begin{cases} n_{Fe}=x(mol)\\ n_{Al}=y(mol) \end{cases} \)
\(n_{H_2}=\dfrac{8,96}{22,4}=0,4(mol)\\ PTHH:2Al+6HCl\to 2AlCl_3+3H_2\\ Fe+2HCl\to FeCl_2+H_2\\ \Rightarrow \begin{cases} 56x+27y=11\\ x+1,5y=0,4 \end{cases} \Rightarrow \begin{cases} x=0,1(mol)\\ y=0,2(mol) \end{cases}\\ \Rightarrow \begin{cases} \%_{Fe}=\dfrac{0,1.56}{11}.100\%=50,91\%\\ \%_{Al}=100\%-50,91\%=49,09\% \end{cases} \)
\(b,\Sigma n_{HCl}=3n_{Al}+2n_{Fe}=0,2+0,6=0,7(mol)\\ \Rightarrow V_{dd_{HCl}}=\dfrac{0,7}{2}=0,35(l)\)

Tác dụng với kim loại
\(Mg+FeSO_4\rightarrow MgSO_4+Fe\)
Tác dụng với axit:
\(Na_2CO_3+2HCl\rightarrow2NaCl+CO_2+H_2O\)
Tác dụng với dd bazo:
\(FeCl_2+2NaOH\rightarrow Fe\left(OH\right)_2+2NaCl\)
Tác dụng vơi dd muối:
\(NaCl+AgNO_3\rightarrow AgCl+NaNO_3\)
Phản ứng phân hủy muối:
\(CaCO_3\xrightarrow[]{t^0}CaO+CO_2\)
`#3107.101107`
`@` Tính Chất Hóa Học của Muối:
`1)` Phản ứng với Kim Loại
Kim Loại + Muối `\rightarrow` Muối Mới + Kim Loại Mới
\(\text{Fe + CuSO}_4\rightarrow\text{ FeSO}_4+\text{Cu}\)
`2)` Phản ứng với Acid
Acid + Muối `\rightarrow` Muối Mới + Acid Mới
Điều kiện: sản phẩm có chất kết tủa hoặc có khí
\(\text{BaCl}_2+\text{H}_2\text{SO}_4\rightarrow\text{ BaSO}_4+\text{2HCl}\)
`3)` Phản ứng với muối
Muối + Muối `\rightarrow` 2 Muối Mới
Điều kiện: sản phẩm kết tủa
\(\text{BaCl}_2+\text{Na}_2\text{SO}_4\rightarrow\text{ BaSO}_4+\text{ 2NaCl}\)
`4)` Phản ứng với base
Muối + Base `\rightarrow` Muối Mới + Base Mới
\(\text{CuSO}_4+\text{2NaOH}\rightarrow\text{ Cu(OH)}_2+\text{Na}_2\text{SO}_4.\)
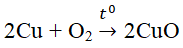
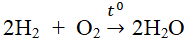
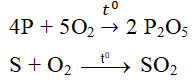
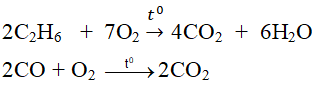
a) \(Mg+H_2SO_4\rightarrow MgSO_4+H_2\)
b) \(n_{Mg}=\dfrac{2,4}{24}=0,1\left(mol\right)\)
Theo PTHH: \(n_{H_2}=n_{Mg}=0,1\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,1.22,4=2,24\left(l\right)\)
c) \(C\%_{MgSO_4}=\dfrac{0,1.120}{2,4+100-0,1.2}.100\%\approx11,74\%\)