Một học sinh cân 18,625g muối potasium halide tác dụng với dung dịch AgNO3 dư, lọc lấy kết tủa đem cân thì nặng 35,875g. Công thức muối của halogen ở trên là
a. KCl
b. KBr
c. KF
d. KI
giải ra như bài tự luận giúp mình với nha <3
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
Gọi công thức muối cần tìm là MX2.
Khi cho 150 gam dung dịch X tác dụng với dung dịch Na2CO3 dư có phản ứng:
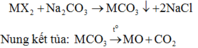
Do đó khí hấp thụ vào dung dịch KOH là CO2.
Vì sau phản ứng trong dung dịch vẫn còn KOH nên sản phẩm tạo thành là K2CO3:
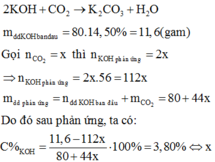 = 0,75
= 0,75

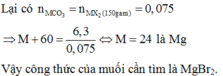

Đáp án C
Gọi công thức chung của NaX và NaY là NaM.
NaM + AgNO3 → AgM↓+NaNO3
0,03 →0,03 (mol)
![]()
=> M = 50,3 => X,Y lần lượt là Cl và Br

Đáp án D
Trường hợp 1: Hai halogen đều tạo được kết tủa với AgNO3
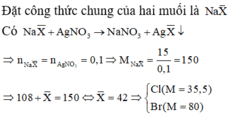
Do đó hai muối trong X là NaCl và NaBr
Trường hợp 2: Hai muối là NaF và NaCl
Phản ứng tạo thành kết tủa chỉ có AgCl và AgF là muối tan:
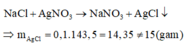
Do đó trường hợp này không thỏa mãn.

Chọn đáp án D
KY + A g N O 3 → K N O 3 + AgY ↓
n K Y = n A g Y => 14 , 9 39 + Y = 28 , 7 108 + Y => Y = 35,5 (Cl) => Muối X là KCl

n AgCl = \(\dfrac{25,83}{143,5}=0,18\) ( mol )
FeCly + AgNO3 → Fe(NO3)y + AgCl ↓
( mol ) \(\dfrac{0,18}{y}\) ← 0,18
m FeCly = \(\dfrac{0,18}{y}+\left(56+35,5y\right)=9,75\)
\(\Leftrightarrow\dfrac{10,08}{y}+6,39=9,75\)
\(\Leftrightarrow\dfrac{10,08}{y}=3,36\)
\(\Leftrightarrow10,08=3,36y\)
\(\Leftrightarrow\dfrac{10,08}{3,36}=3\)
Cồn thức hóa học của muối sắt là: FeCl3

Chọn đáp án B
NaY + A g N O 3 → A g N O 3 + AgY
2AgY → 2Ag + Y 2
n N a Y = n A g Y = n A g = = 0,03 (mol
0,03(23+ M Y ) = 3,09 => M Y = 80 (Br)

Chọn đáp án B
NaY + A g N O 3 → N a N O 3 + AgY
2AgY → 2Ag + Y 2
n N a Y = n A g Y = n A g = = 0,01 (mol)
=> 0,01(23 + M Y ) = 1,03 => M Y = 80 (Br)

Đáp án : B
NaX + AgNO3 -> NaNO3 + AgX
x mol -> x mol
=> 2,06/(23 + X) = 3,76/(108 + X)
=> X = 80 (Br)
\(n_{halogen}=\dfrac{35,875-18,625}{108-39}=0,25\left(mol\right)\\ M_{muối\left(t.gia\right)}=\dfrac{18,625}{0,25}=74,5=39+M_{halogen}\\ \Leftrightarrow M_{halogen}=35,5\left(\dfrac{g}{mol}\right)\\ Vậy.muối.halogen.đó:KCl\left(Cl=35,5\right)\\ Chọn.A\)