Đốt cháy hoàn toàn 6 gam hợp chất hữu cơ A rồi cho sản phẩm thu được qua bình 1 đựng H2SO4 đặc, sau đó qua bình 2 đựng dung dịch Ca(OH)2 dư. Sau phản ứng thấy khối lượng bình tăng thêm 3,6 gam, ở bình 2 có 20 gam kết tủa. a) Hãy xác định công thức phân tử của A b) Viết các công thức cấu tạo có thể có của A, biết A làm quỳ tím chuyển sang màu đỏ.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Chất A chứa C, H, O khi đốt cháy sẽ sinh ra CO 2 và H 2 O . Khi qua bình 1 đựng H 2 SO 4 đặc thì H 2 O bị hấp thụ. Vậy khối lượng H 2 O là 1,8 gam. Qua bình 2 có phản ứng :
Ca OH 2 + CO 2 → CaCO 3 ↓+ H 2 O
Theo phương trình : n CO 2 = n CaCO 3 = 10/100 = 0,1 mol
Vậy khối lượng cacbon có trong 3 gam A là 0,1 x 12 = 1,2 (gam).
Khối lượng hiđro có trong 3 gam A là 0,1 x 2 = 0,2 (gam).
Khối lượng oxi có trong 3 gam A là 3 - 1,2 - 0,2 = 1,6 (gam).
Gọi công thức phân tử của A là C x H y O z
Ta có :
60 gam A → 12x gam C → y g H → 16z gam O
3 gam → 1,2 gam → 0,2 gam → 1,6 gam
x = 1,2x60/36 = 2; y = 60x0,2/3 = 4
z = 1,6x60/48 = 2
→ Công thức phân tử của A là C 2 H 4 O 2

Đáp án A
Đốt cháy X tạo CO2 và H2O
Bình 1 giữ lại H2O => mH2O = 7,2g => nH = 2nH2O = 0,8 mol
Bình 2 giữ lại CO2 : nCaCO3 = nCO2 = 0,3 mol
Có : mC + mH + mO = mX => nO = 0,1mol
=> nC : nH : nO = 0,3 : 0,8 : 0,1 = 3 : 8 : 1
Vậy CTĐG nhất của X là C3H8O

Chọn đáp án A
Bình 1 hấp thụ H2O, bình 2 hấp thụ CO2.
m H 2 O = 3 , 6 g a m ⇒ n H 2 O = 0 , 2 m o l
Hỗn hợp gồm các este no, đơn chức, mạch hở nên n C O 2 = n H 2 O = 0 , 2 m o l
n C a ( O H ) 2 = 0 , 3 m o l . n C O 2 > n C a ( O H ) 2 ⇒ C a ( O H ) 2 dư, n C a C O 3 = n C O 2 = 0 , 2 m o l
m = m C a C O 3 = 0 , 2 . 100 = 20

Vì A làm quỳ tím chuyển sang màu đỏ nên A là một axit → Trong phân tử A có nhóm -COOH.
Vậy công thức cấu tạo của A là CH 3 -COOH.

Đáp án A
nCO2=nCaCO3=35/100=0,35 mol
nH2O=3,6/18=0,2 mol
=>mO=mX-mC-mH=5,4 -12.0,35-1.2.0,2=0,8 g
=> nO=0,05 mol
nC:nH:nO=0,35:0,4:0,05=7:8:1
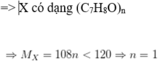
=> CTPT của X là C7H8O
X phản ứng với Na suy ra X có nhóm -OH => Các CTCT của X là
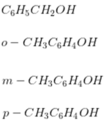

-gọi CTPT là CxHyOzN
-khối lượng bình (1) tăng là mH2O
⇒nH2O = 0,14 mol ⇒nH = 0,28 mol
-khối lượng bình (2) tăng là mCO2
⇒ nCO2 = 0,08 mol = nC
đốt 9 gam chất sinh ra 0,1 mol N2
đốt 1,8 gam →0,02mol N2
ta có : nN2 = 0,02mol ⇒nN = 0,04mol
bảo toàn khối lượng ta có :
mo = 1,8 - mH - mC - mN = 0 → trong chất không có oxi
→CTPT là CxHyN7
x:y:0,04 = 0,08 : 0,28 : 0,04 = 2: 7:1
→ công thức phân tử là C2H7N

Ta có: \(n_{H_2O}=\dfrac{3,6}{18}=0,2\left(mol\right)\Rightarrow n_H=0,2.2=0,4\left(mol\right)\)
\(n_C=n_{CO_2}=n_{CaCO_3}=\dfrac{30}{100}=0,3\left(mol\right)\)
⇒ mC + mH = 0,3.12 + 0,4.1 = 4 (g) < 10,4 (g)
→ A chứa C, H và O.
⇒ mO = 10,4 - 4 = 6,4 (g) ⇒ nO = 0,4 (mol)
Gọi CTPT của A là CxHyOz.
⇒ x:y:z = 0,3:0,4:0,4 = 3:4:4
→ CTPT của A có dạng (C3H4O4)n.
Mà: \(n_{A\left(5,2\left(g\right)\right)}=n_{O_2}=\dfrac{1,6}{32}=0,05\left(mol\right)\Rightarrow M_A=\dfrac{5,2}{0,05}=104\left(g/mol\right)\)
\(\Rightarrow n=\dfrac{104}{12.3+4+16.4}=1\)
Vậy: CTPT của A là C3H4O4.

a, \(n_{H_2O}=\dfrac{3,6}{18}=0,2\left(mol\right)\Rightarrow n_H=0,2.2=0,4\left(mol\right)\)
\(n_{CO_2}=n_{CaCO_3}=\dfrac{20}{100}=0,2\left(mol\right)=n_C\)
⇒ mC + mH = 0,2.12 + 0,4.1 = 2,8 (g) < mA
→ A gồm C, H và O.
⇒ mO = 6 - 2,8 = 3,2 (g) \(\Rightarrow n_O=\dfrac{3,2}{16}=0,2\left(mol\right)\)
Gọi CTPT của A là CxHyOz.
⇒ x:y:z = 0,2:0,4:0,2 = 1:2:1
→ CTPT của A có dạng (CH2O)n
Không biết đề có cho thêm dữ kiện liên quan đến MA không bạn nhỉ?