Tính khối lượng dd axit axetic 12% cần dùng để trung hoà vừa đủ 250 ml đ NAOH 1M
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a) H2SO4 + 2NaOH --> Na2SO4 + 2H2O
b) \(n_{H_2SO_4}=0,2.1=0,2\left(mol\right)\)
PTHH: H2SO4 + 2NaOH --> Na2SO4 + 2H2O
0,2---->0,4
=> mNaOH = 0,4.40 = 16 (g)
=> \(m_{dd.NaOH}=\dfrac{16.100}{20}=80\left(g\right)\)
c)
PTHH: H2SO4 + 2KOH --> K2SO4 + 2H2O
0,2---->0,4
=> mKOH = 0,4.56 = 22,4 (g)
=> \(m_{dd.KOH}=\dfrac{22,4.100}{5,6}=400\left(g\right)\)
=> \(V_{dd.KOH}=\dfrac{400}{1,045}=382,775\left(ml\right)\)
\(n_{H_2SO_4}=0,2.1=0,2\left(mol\right)\\ pthh:H_2SO_4+2NaOH\rightarrow Na_2SO_4+2H_2O\)
0,2 0,4
\(m_{\text{ }NaOH}=0,4.40=16g\\ m_{\text{dd}NaOH}=\dfrac{16.100}{20}=80g\)
\(pthh:H_2SO_4+2KOH\rightarrow K_2SO_4+2H_2O\)
0,2 0,4
\(m_{KOH}=0,4.56=22,4g\\
m_{\text{dd}KOH}=\dfrac{22,4.100}{5,6}=400g\\
V_{\text{dd}}=\dfrac{400}{1,045}=382,7ml\)
\(V_{dd}=\dfrac{22,4}{1,045}=21,4354ml\)

n NaOH = 0,06 mol . Theo đề phản ứng trung hòa vừa đủ => tổng n các axit = 0,06 mol ( tỉ lệ 1:1)
1 mol axit thành 1 mol muối natri khối lượng tăng 22g
=> 0,06 mol axit thành 0,06 mol Na khối lượng tăng 1,32g
=> m muối = m rắn = 5,48 + 1,32 = 6,8g .
=> Đáp án A

a) nH2SO4 = 0,2 . 1 = 0,2 mol
H2SO4 + 2NaOH -> Na2SO4 + 2H2O
0,2 0,4
mNaOH = 0,4 . 40 = 16g
mddNaOH = \(\frac{16.100\%}{20\%}=80g\)
b) 2KOH + H2SO4 -> K2SO4 + 2H2O
0,4 <---------- 0,2
=> mKOH = 0,4 . 56 = 22,4 g
mddKOH = \(\frac{22,4.100\%}{5,6\%}=400g\)
VddKOH = \(\frac{400}{1,045}=383ml\)

Đáp án : C
Ta có:
60nCH3COOH + 72nC2H3COOH + 74nC2H5COOH=3,15
nC2H3COOH=nBr2=0,02
nCH3COOH + nC2H3COOH + nC2H5COOH=nNaOH=0,045
=> nCH3COOH = 0,01 mol
=> % CH3COOH = 0 , 01 . 60 3 , 15 = 19,05 %

nKOH = 0,25 . 2 = 0,5 mol
nKOH dư = nHCl = 0,1 mol
=> nKOH phản ứng = 0,4 mol = nhh axit (1)
=> Mhh = \(\dfrac{22,6}{0,4}\) = 56,5 g/mol
<=> có một axit có M < 56,5 là HCOOH
Giả sử số mol của HCOOH là 3x mol
=> số mol của axit X còn lại là 5x mol
Theo (1) ta có 5x + 3x = 0,4 <=> x = 0,05 mol
=> mHCOOH = 0,05.3.46 = 6,9 gam
<=> m X = 22,6 -6,9 = 15,7 gam
<=> MX = \(\dfrac{15,7}{0,25}\)= 62,8 g/mol (vô lý)
Vậy số mol của HCOOH là 5x = 0,25 mol và số mol của X là 0,15 mol
<=> mX = 22,6 - 0,25.46 = 11,1 g
=> mHCOOH > mX
=> %mHCOOH = \(\dfrac{0,25.46}{22,6}\).100% = 50,88%
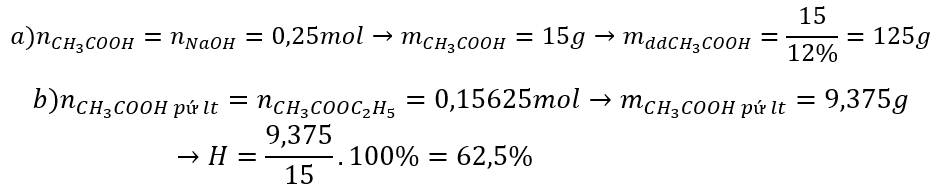


\(n_{NaOH}=0,25.1=0,25\left(mol\right)\)
PT: \(CH_3COOH+NaOH\rightarrow CH_3COONa+H_2O\)
Theo PT: \(n_{CH_3COOH}=n_{NaOH}=0,25\left(mol\right)\)
\(\Rightarrow m_{CH_3COOH}=0,25.60=15\left(g\right)\Rightarrow m_{ddCH_3COOH}=\dfrac{15}{12\%}=125\left(g\right)\)