Trong phòng thí nghiệm để điều chế được 5,6 lít khí O2 (đktc) cần phải dùng bao nhiêu gram Kali Clorat vậy mọi ng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(2KClO_3\xrightarrow[]{t^o}2KCl+3O_2\)
\(n_{O_2}=\dfrac{V_{O_2}}{22,4}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
Theo PTHH: \(n_{KClO_3}=\dfrac{0,25.2}{3}\approx0,17\left(mol\right)\)
Vậy muốn điều chế 5,6 lít O2 cần dùng số gam Kali clorat:
\(m_{KClO_3}=n_{KClO_3}.M_{KClO_3}=0,17.122,5=20,825g\)
\(n_{O2}\)=\(\dfrac{V}{22,4}\)=\(\dfrac{5,6}{22,4}\)=0,25 (mol)
PT : 2KClO3 →to 2KCl + 3O2
số mol: \(\dfrac{1}{6}\) ← \(\dfrac{1}{6}\) ← 0,25
⇒ mKClO3 = n . M = \(\dfrac{1}{6}\) . 122,5 ∼∼ 20,41(g)

a) \(n_{O_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PTHH: 2KClO3 --to--> 2KCl + 3O2
0,2<-------------------0,3
=> \(m_{KClO_3}=0,2.122,5=24,5\left(g\right)\)
b) \(n_{KClO_3}=\dfrac{490}{122,5}=4\left(mol\right)\)
PTHH: 2KClO3 --to--> 2KCl + 3O2
4-------------->4---->6
=> \(m_{KCl}=4.74,5=298\left(g\right)\)
=> \(m_{O_2}=6.32=192\left(g\right)\)
2KClO3 \(\underrightarrow{t^o}\) 2KCl + 3O2
a, \(n_{O_2}=\dfrac{6,72}{22,4}=0,3mol\\ n_{KClO_3}=\dfrac{0,3.2}{3}=0,2mol\\ m_{KClO_3}=0,2.122,5=24,5g\)
b, \(n_{KClO_3}=\dfrac{490}{122,5}=4mol\)
\(\Rightarrow m_{KCl}=4.74,5=298g\)
\(n_{O_2}=\dfrac{4.3}{2}=6mol\\ m_{O_2}=6.32=192g\)

nO2=6,72/22,4=0,3(mol)
PTHH: 2 KClO3 -to->2 KCl +3 O2
Ta có: nKClO3=2/3. 0,3=0,2(mol)
=>mKClO3=0,2.122,5=24,5(g)

PTHH: \(3Fe+2O_2\xrightarrow[]{t^o}Fe_3O_4\)
Ta có: \(n_{Fe_3O_4}=\dfrac{2,32}{232}=0,01\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}n_{O_2}=0,02\left(mol\right)\\n_{Fe}=0,03\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{Fe}=0,03\cdot56=1,68\left(g\right)\\V_{O_2}=0,02\cdot22,4=0,448\left(l\right)\end{matrix}\right.\)

\(n_{Fe_3O_4}=\dfrac{m}{M}=\dfrac{4,64}{232}=0,02mol\)
\(3Fe+2O_2\rightarrow\left(t^o\right)Fe_3O_4\)
0,06 0,04 0,02 ( mol )
\(m_{Fe}=n_{Fe}.M_{Fe}=0,06.56=3,36g\)
\(V_{O_2}=n_{O_2}.22,4=0,04.22,4=0,896l\)

nFe3O4 = 2,32/232 = 0,01 mol
3Fe + 2O2 ➝ Fe3O4
0,03 0,02 0,01 (mol)
a) mFe = 0,03.56 = 1,68 gam
b) VO2 = 0,02.22,4 = 0,448 lít
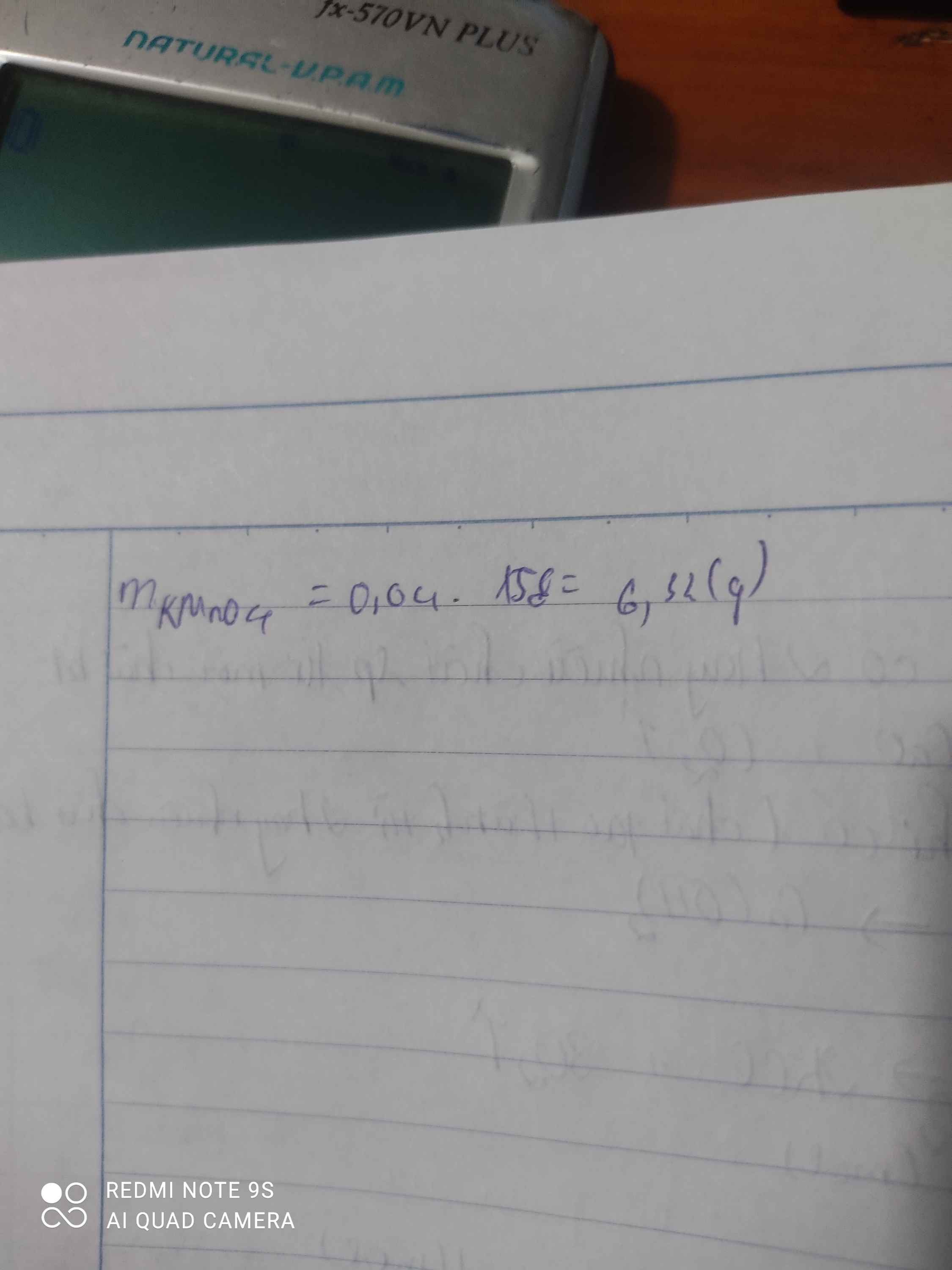

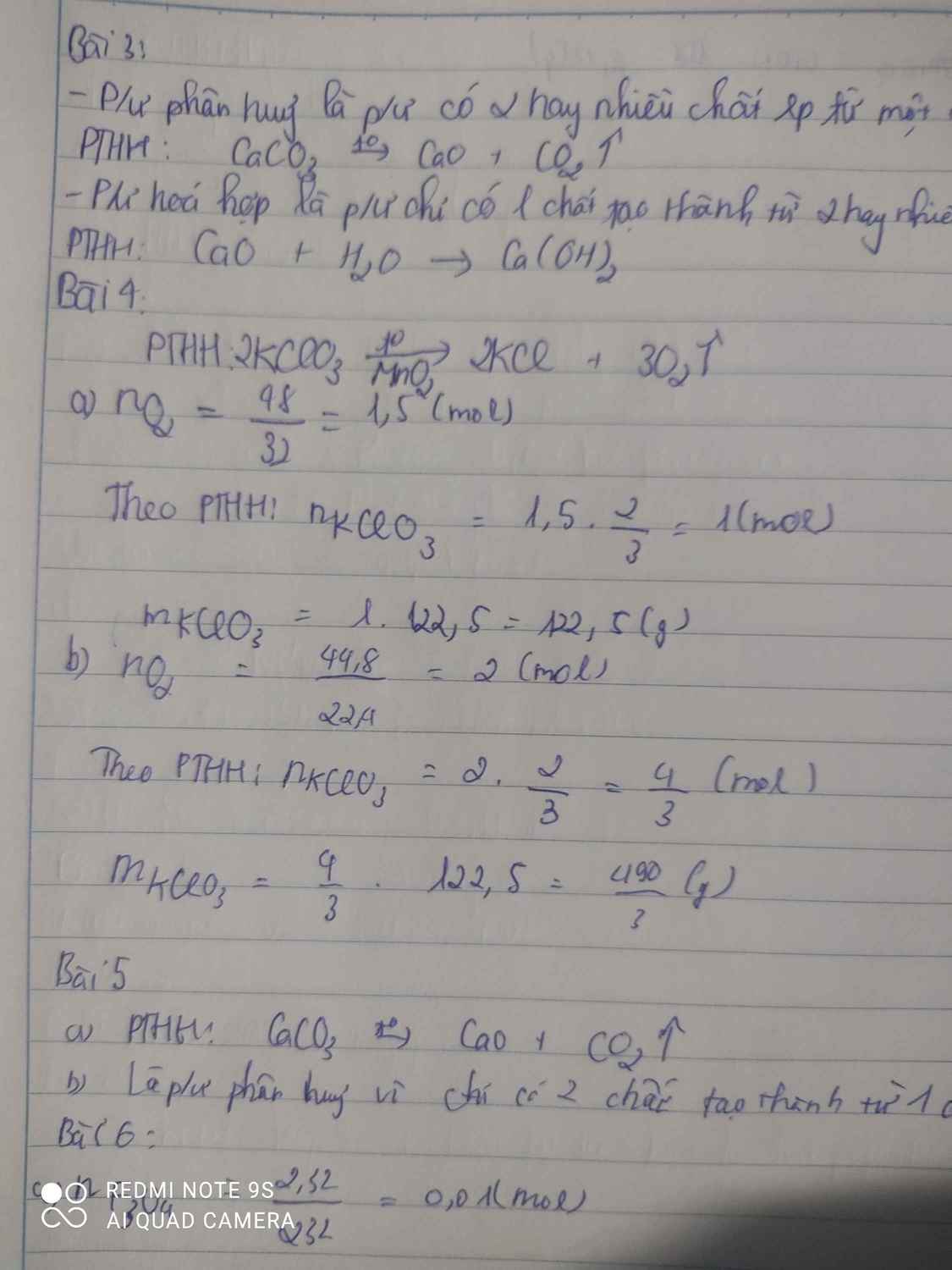
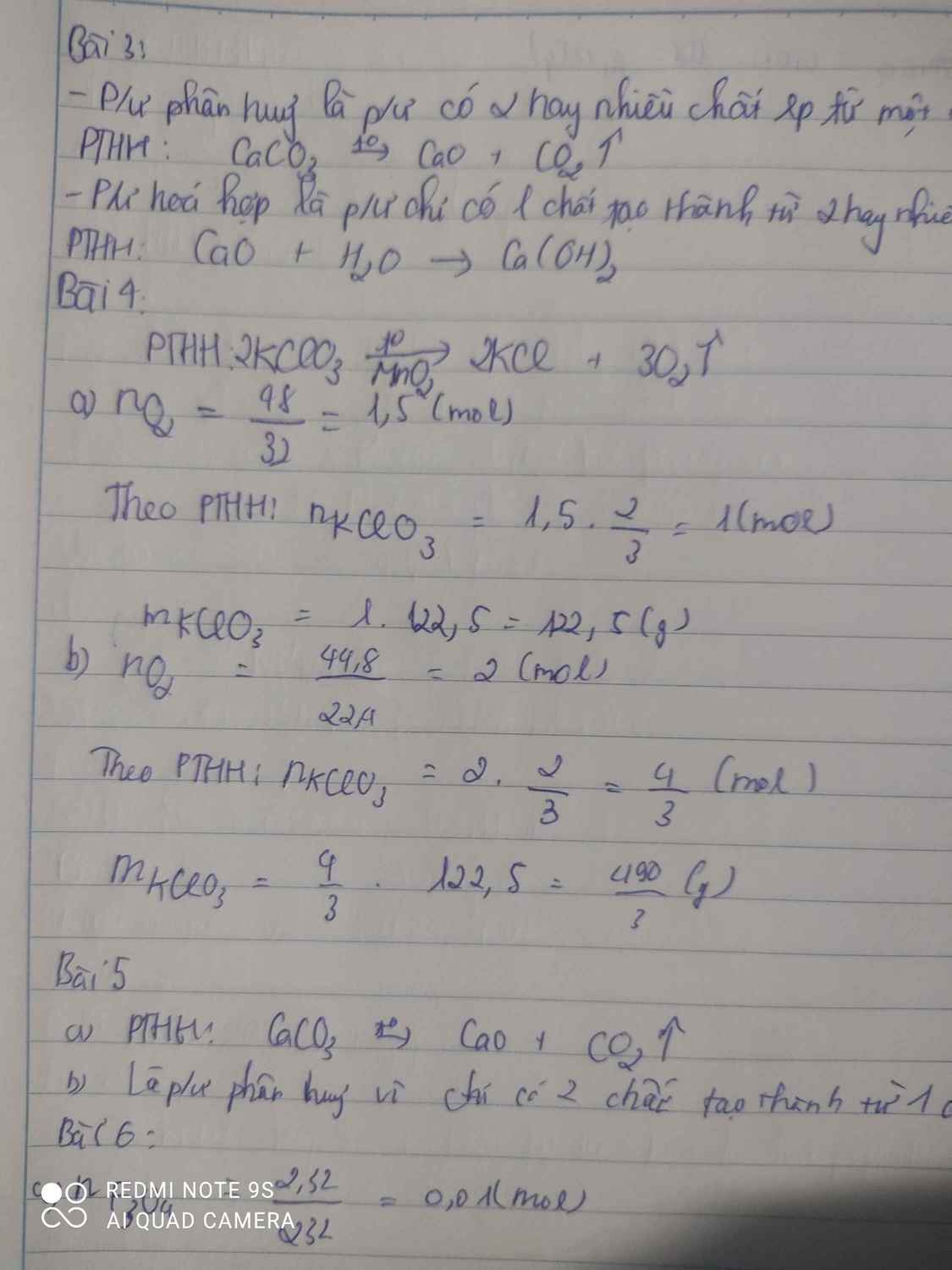

\(n_{O_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
PT: \(2KClO_3\underrightarrow{t^o}2KCl+3O_2\)
Theo PT: \(n_{KClO_3}=\dfrac{2}{3}n_{O_2}=\dfrac{1}{6}\left(mol\right)\Rightarrow m_{KClO_3}=\dfrac{1}{6}.122,5=\dfrac{245}{12}\left(g\right)\)