đốt cháy hoàn toàn 4,48 lít hỗn hợp gồm khí Etilen và Axetilen cần dùng vừa đủ 12,32 lít khí oxi . Hãy tính phần trăm theo thể tích các khí trong hỗn hợp ban đầu ( các thể tích khí đởn cùng điều kiện nhiệt độ và áp suất ) - giúp mình với mình cần gấp -
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


C2H2+2Br2->C2H2Br4
x-----------2x
C2H4+Br2->C2H4Br2
y-----------2y
n Br2=0,8 mol
\(\left\{{}\begin{matrix}x+y=0,6\\2x+y=0,8\end{matrix}\right.\)
=>x=0,2 ,y=0,4 mol
=>%VC2H2=\(\dfrac{0,2.22,4}{13,44}100\)=33,33%
=>%C2H4=66,67%
C2H4+3O2-tO>2CO2+2H2O
C2H2+5\2O2-to>2CO2+H2O
=>Vkk=1,7.22,4.5=190,4l

Giả sử các khí đo ở điều kiện sao cho 1 mol khi có thể tích V lít
\(n_{CO}+n_{CO_2}=\dfrac{20}{V}\)
\(n_{O_2}=\dfrac{8}{V}\left(mol\right)\)
PTHH: 2CO + O2 --to--> 2CO2
_____\(\dfrac{16}{V}\)<---\(\dfrac{8}{V}\)
=> \(\left\{{}\begin{matrix}n_{CO}=\dfrac{16}{V}\\n_{CO_2}=\dfrac{20}{V}-\dfrac{16}{V}=\dfrac{4}{V}\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}\%V_{CO}=\dfrac{\dfrac{16}{V}}{\dfrac{20}{V}}.100\%=80\%\\\%V_{CO_2}=\dfrac{\dfrac{4}{V}}{\dfrac{20}{V}}.100\%=20\%\end{matrix}\right.\)

\(n_{hh}=\dfrac{3,36}{22,4}=0,15mol\)
\(n_{CO_2}=\dfrac{4,48}{22,4}=0,2mol\)
\(\left\{{}\begin{matrix}n_{CH_4}=x\left(mol\right)\\n_{C_2H_2}=y\left(mol\right)\end{matrix}\right.\)
\(CH_4+2O_2\rightarrow CO_2+2H_2O\)
\(C_2H_2+\dfrac{5}{2}O_2\rightarrow2CO_2+H_2O\)
Từ hai pt trên:\(\Rightarrow\left\{{}\begin{matrix}x+y=0,15\\x+2y=0,2\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,1\\y=0,05\end{matrix}\right.\)
\(\%V_{CH_4}=\dfrac{0,1}{0,1+0,05}\cdot100\%=66,67\%\)
\(\%V_{C_2H_2}=100\%-66,67\%=33,33\%\)
\(n_{CO_2}=\dfrac{V_{CO_2}}{22,4}=\dfrac{4,48}{22,4}=0,2mol\)
Gọi \(n_{CH_4}\) là x \(\Rightarrow V_{CH_4}=22,4x\)
\(n_{C_2H_2}\) là y \(\Rightarrow V_{C_2H_2}=22,4y\)
\(CH_4+2O_2\rightarrow\left(t^o\right)CO_2+2H_2O\)
x x ( mol )
\(2C_2H_2+5O_2\rightarrow\left(t^o\right)4CO_2+2H_2O\)
y 2y ( mol )
Ta có:
\(\left\{{}\begin{matrix}22,4x+22,4y=3,36\\x+2y=0,2\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}x=0,1\\y=0,05\end{matrix}\right.\)
\(\Rightarrow V_{CH_4}=22,4.0,1=2,24l\)
\(\Rightarrow V_{C_2H_2}=22,4.0,05=1,12l\)
\(\%V_{CH_4}=\dfrac{2,24}{3,36}.100=66,67\%\)
\(\%V_{C_2H_2}=100\%-66,67\%=33,33\%\)

a)
\(\left\{{}\begin{matrix}V_{C_2H_2}=x\left(ml\right)\\V_{C_2H_4}=y\left(ml\right)\end{matrix}\right.\)⇒ x + y = 50(1)
\(C_2H_2 +\dfrac{5}{2} O_2 \xrightarrow{t^o} 2CO_2 + H_2O\\ C_2H_4 + 3O_2 \xrightarrow{t^o} 2CO_2 + 2H_2O\)
Theo PTHH : 2,5x + 3y = 140(2)
Từ (1)(2) suy ra: x = 20 ; y = 30
Vậy :
\(\%V_{C_2H_2} = \dfrac{20}{50}.100\% = 40\%\\ \%V_{C_2H_4} = 100\% - 40\% = 60\%\)
b)
\(V_{CO_2} = 2V_{C_2H_2} + 2V_{C_2H_4} = 2.50 = 100(ml)\)
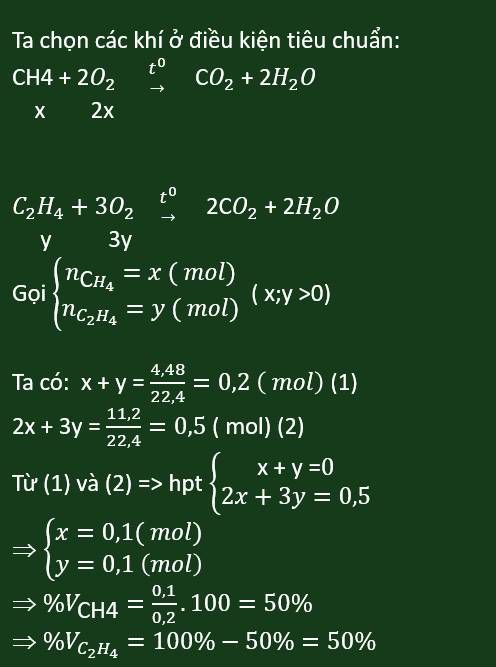

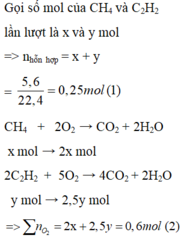

PT: \(C_2H_4+3O_2\underrightarrow{t^o}2CO_2+2H_2O\)
\(2C_2H_2+5O_2\underrightarrow{t^o}4CO_2+2H_2O\)
Ta có: \(n_{C_2H_4}+n_{C_2H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\left(1\right)\)
Theo PT: \(n_{O_2}=3n_{C_2H_4}+\dfrac{5}{2}n_{C_2H_2}=\dfrac{12,32}{22,4}=0,55\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow n_{C_2H_4}=n_{C_2H_2}=0,1\left(mol\right)\)
\(\Rightarrow\%V_{C_2H_4}=\%V_{C_2H_2}=\dfrac{0,1.22,4}{4,48}.100\%=50\%\)