Đốt cháy hoàn toàn 1,68 lít hh gồm butan và hexan thu được 8,96 lít CO2 và 8,55g H2O . Tính m hỗn hợp và %n mỗi chất trong hỗn hợp
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án A
Áp dụng định luật bảo toàn nguyên tố:
![]()
Khi cho T qua dung dịch nước brom thì C2H4, C2H4, C4H8, C4H6 phản ứng với brom.
![]() (1)
(1)
![]() (2)
(2)
Từ (1) và (2) có
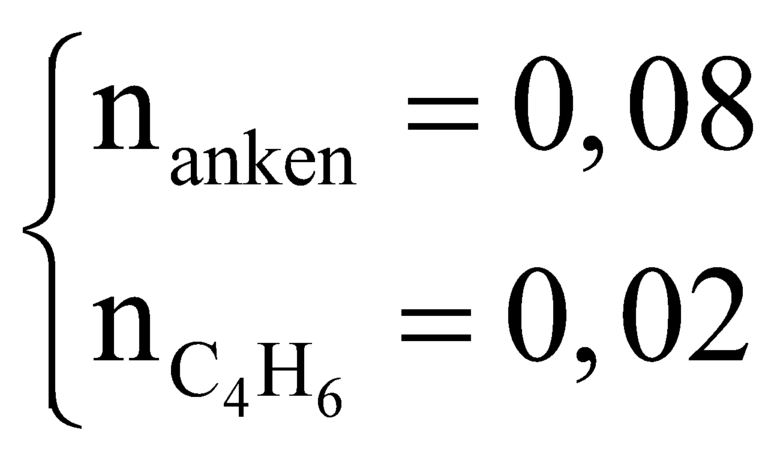
![]()

Chọn đáp án B.
Đặt số mol glyxin là x, etylamin là y.
⇒ n C O 2 = 2 x + 2 y = 0 , 4 m o l n H 2 O = 2 , 5 x + 3 , 5 y = 0 , 6 m o l
⇒ x = 0 , 1 y = 0 , 1
⇒ % m C 2 H 5 N H 2 = 37 , 5 %

n CO2 = 8,96/22,4 = 0,4(mol)
n H2O = 9/18 = 0,5(mol)
n ankan = n H2O - n CO2 = 0,5 - 0,4 = 0,1(mol)
n anken = n Br2 = 0,075(mol)
C4H10 → C3H6 + CH4
C4H10 → C2H4 + C2H6
C4H10 → C4H10(dư)
Ta thấy :
n C4H10 ban đầu = n ankan = n C3H6 + n C2H4 + n C4H10 dư = 0,1(mol)
n C4H10 phản ứng = n C2H4 + n C3H6 = n anken = 0,075(mol)
=> H =0,075/0,1 .100% = 75%




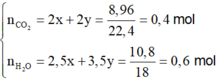
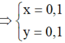
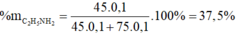
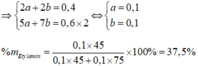
PT: \(C_4H_{10}+\dfrac{13}{2}O_2\underrightarrow{t^o}4CO_2+5H_2O\)
\(C_6H_{14}+\dfrac{19}{2}O_2\underrightarrow{t^o}6CO_2+7H_2O\)
Ta có: \(n_{C_4H_{10}}+n_{C_6H_{14}}=\dfrac{1,68}{22,4}=0,075\left(mol\right)\left(1\right)\)
Theo PT: \(n_{CO_2}=4n_{C_4H_{10}}+6n_{C_6H_{14}}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{C_4H_{10}}=0,025\left(mol\right)\\n_{C_6H_{14}}=0,05\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow m_{hh}=m_{C_4H_{10}}+m_{C_6H_{14}}=5,75\left(g\right)\)
\(\left\{{}\begin{matrix}\%n_{C_4H_{10}}=\dfrac{0,025}{0,025+0,05}.100\%\approx33,33\%\\\%n_{C_6H_{14}}\approx66,67\%\end{matrix}\right.\)