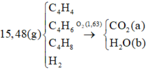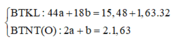Cho 20g hỗn hợp A gồm 3 khí metan, propilen, axetilen lần lượt qua bình 1 đựng dung dịch AgNO3 / NH3 dư, bình 2 đựng dung dịch Br2 dư thấy bình 1 có 48 g kết tủa vàng, bình 2 có 32g brom phản ứng. Viết các phản ứng xảy ra? Tính % thể tích mỗi chất trong hỗn hợp ban đầu?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(C_2H_2+AgNO_3+NH_3->C_2Ag_2+NH_4NO_3\\ CH_2=CH-CH_3+Br_2->CH_2Br-CHBr-CH_3\\ n_{C_2Ag_2}=0,325mol=n_{C_2H_2}\\ m_{C_2H_2}=8,45g\\ n_{Br_2}=n_{C_3H_6}=\dfrac{32}{160}=0,2mol\\ m_{C_3H_6}=8,4g\\ m_{CH_4}=20-8,45-8,4=3,15g\\ n_{CH_4}=0,196875mol\\ n_{hh}=n_{CH_4}+n_{C_2H_2}+n_{C_3H_6}=0,721875mol\\ \%V_{C_3H_6}=\dfrac{0,2}{n_{hh}}.100\%=27,71\%\\ \%V_{C_2H_2}=\dfrac{0,325}{n_{hh}}.100\%=45,02\%\\ \%V_{CH_{_34}}=27,27\%\)

Ta có: \(n_X=\dfrac{3,584}{22,4}=0,16\left(mol\right)\)
- Cho hh khí quá bình 1:
PT: \(C_3H_4+AgNO_3+NH_3\rightarrow AgC_3H_3+NH_4NO_3\)
Ta có: \(n_{AgC_3H_3}=\dfrac{5,88}{147}=0,04\left(mol\right)\)
Theo PT: \(n_{C_3H_4}=n_{AgC_3H_3}=0,04\left(mol\right)\)
- Cho tiếp hh khí còn lại qua bình 2, thấy dd Br2 nhạt màu.
→ Br2 dư, C2H4 pư hết. Khí thoát ra là C3H8.
PT: \(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
Ta có: \(n_{C_3H_8}=\dfrac{1,792}{22,4}=0,08\left(mol\right)\)
a, \(\left\{{}\begin{matrix}\%V_{C_2H_4}=\dfrac{0,16-0,08-0,04}{0,16}.100\%=25\%\\\%V_{C_3H_4}=\dfrac{0,04}{0,16}.100\%=25\%\\\%V_{C_3H_8}=50\%\end{matrix}\right.\)
b, Ta có: \(n_X=\dfrac{1,792}{22,4}=0,08\left(mol\right)\)
\(\Rightarrow X\left\{{}\begin{matrix}n_{C_2H_4}=0,08.25\%=0,02\left(mol\right)\\n_{C_3H_4}=0,08.25\%=0,02\left(mol\right)\\n_{C_3H_8}=0,04\left(mol\right)\end{matrix}\right.\) \(\Rightarrow n_{\pi}=n_{C_2H_4}+2n_{C_3H_4}=0,06\left(mol\right)\)
\(n_{Br_2}=0,08.1=0,08\left(mol\right)\)
⇒ nπ < nBr2
→ Br2 dư. Hiện tượng: Dd Br2 nhạt màu dần.

Đáp án : A
Hỗn hợp X có : 0,2 mol C2H2 ; 0,1 mol C3H6 ; 0,3 mol H2
Bảo toàn khối lượng : mX = mY = 10g
MY : MX = 12 : 7 => nX : nY = 12 : 7
=> nY = 0,35 mol => nH2 pứ = 0,25 mol
Có npi (X) = 2nC2H2 + nC3H6 = 0,5 mol => nPi(Y) = npi (X) – nH2 pứ = 0,25 mol
Y phản ứng được với AgNO3/NH3 => nAg2C2 = nC2H2 = 0,05 mol
=> npi (Z) = npi(Y) – 2nC2H2 (Y) = 0,15 mol
=> nBr2 = npi (Z) = 0,15 mol => m = 24g

a)
C2H2 + 2AgNO3 + 2NH3 --> C2Ag2 + 2NH4NO3
C3H6 + Br2 --> C3H6Br2
b)
\(n_{C_2Ag_2}=\dfrac{3,6}{240}=0,015\left(mol\right)\)
=> nC2H2 = 0,015 (mol)
\(m_{tăng}=m_{C_3H_6}=2,1\left(g\right)\)
=> \(n_{C_3H_6}=\dfrac{2,1}{42}=0,05\left(mol\right)\)
\(n_{C_2H_6}=\dfrac{0,784}{22,4}=0,035\left(mol\right)\)
\(\left\{{}\begin{matrix}\%V_{C_2H_6}=\dfrac{0,035}{0,035+0,05+0,015}.100\%=35\%\\\%V_{C_3H_6}=\dfrac{0,05}{0,035+0,05+0,015}.100\%=50\%\\\%V_{C_2H_2}=\dfrac{0,015}{0,035+0,05+0,015}.100\%=15\%\end{matrix}\right.\)
\(\left\{{}\begin{matrix}\%m_{C_2H_6}=\dfrac{0,035.30}{0,035.30+0,05.42+0,015.26}.100\%=29,661\%\\\%m_{C_3H_6}=\dfrac{0,05.42}{0,035.30+0,05.42+0,015.26}.100\%=59,322\%\\\%m_{C_2H_2}=\dfrac{0,015.26}{0,035.30+0,05.42+0,015.26}.100\%=11,017\%\end{matrix}\right.\)
c)
\(n_{CaCO_3}=\dfrac{5}{100}=0,05\left(mol\right)\)
Bảo toàn C: \(n_{CaCO_3}+2.n_{Ca\left(HCO_3\right)_2}=0,25\left(mol\right)\)
=> \(n_{Ca\left(HCO_3\right)_2}=0,1\left(mol\right)\)
Bảo toàn Ca: \(n_{Ca\left(OH\right)_2}=0,15\left(mol\right)\)
=> \(V_{dd.Ca\left(OH\right)_2}=\dfrac{0,15}{1}=0,15\left(l\right)=150\left(ml\right)\)

a) \(n_{C_2Ag_2}=\dfrac{48}{240}=0,2\left(mol\right)\)
=> nC2H2 = 0,2 (mol)
\(n_{Br_2}=\dfrac{24}{160}=0,15\left(mol\right)\)
PTHH: C2H4 + Br2 --> C2H4Br2
0,15<--0,15
\(n_{C_3H_8}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
\(\left\{{}\begin{matrix}\%V_{C_3H_8}=\dfrac{0,15}{0,15+0,15+0,2}.100\%=30\%\\\%V_{C_2H_4}=\dfrac{0,15}{0,15+0,15+0,2}.100\%=30\%\\\%V_{C_2H_2}=\dfrac{0,2}{0,15+0,15+0,2}.100\%=40\%\end{matrix}\right.\)
\(\left\{{}\begin{matrix}\%m_{C_3H_8}=\dfrac{0,15.44}{0,15.44+0,15.28+0,2.26}.100\%=41,25\%\\\%m_{C_2H_4}=\dfrac{0,15.28}{0,15.44+0,15.28+0,2.26}.100\%=26,25\%\\\%m_{C_2H_2}=\dfrac{0,2.26}{0,15.44+0,15.28+0,2.26}.100\%=32,5\%\end{matrix}\right.\)
b) Bảo toàn C; nCaCO3 = 1,15 (mol)
=> mCaCO3 = 1,15.100 = 115 (g)
c) \(n_{C_2H_2\left(bđ\right)}=\dfrac{0,2}{2}=0,1\left(mol\right)\)
=> nC2Ag2(lý thuyết) = 0,1 (mol)
\(H\%=\dfrac{19,2}{0,1.240}.100\%=80\%\)
https://hoc24.vn/cau-hoi/hon-hop-a-chua-etanpropenetincho-hon-hop-a-di-qua-dung-dich-chua-agno3nh3-dusau-phan-ung-thu-duoc-36-gam-ket-tua-vang-va-hon-hop-khi-bdan-toan-bo-b-qua-binh-dung-dung-dich-brom-duthay-khoi-luo.5464617579599
giúp mình câu này nữa mình tick cho

\(n_{C_3H_3Ag}=\dfrac{7,35}{147}=0,05\left(mol\right)\)
=> \(n_{C_3H_4}=0,05\left(mol\right)\)
\(n_{Br_2}=\dfrac{6,4}{160}=0,04\left(mol\right)\)
=> \(n_{C_2H_4}=0,04\left(mol\right)\)
=> \(\left\{{}\begin{matrix}\%C_3H_4=\dfrac{0,05.40}{5,52}.100\%=36,23\%\\\%C_2H_4=\dfrac{0,04.28}{5,52}.100\%=20,29\%\\\%C_2H_6=100\%-36,23\%-20,29\%=43,48\%\end{matrix}\right.\)
=> A