Hỗn hợp Z gồm 3 hiđrocacbon là C3H8, CxHy và CxH2x có tỉ lệ mol tương ứng là 1:2:3. Dẫn V lit hỗn hợp Z vào bình đựng dung dịch brom (dư) thấy số mol brom phản ứng tối đa là 0,18 mol và còn lại hỗn hợp khí T thoát ra khỏi bình chỉ chứa 2 hiđrocacbon có thể tích bằng 50% thể tích của hỗn hợp Z ban đầu. Mặt khác, nếu đốt cháy hoàn toàn 16,128 lit hỗn hợp Z trên bằng lượng oxi vừa đủ rồi dẫn toàn bộ sản phẩm cháy lần lượt đi qua bình 1 chứa dung dịch H2SO4 đặc (dư), sau đó dẫn tiếp qua bình 2 chứa 2,0 lit dung dịch Ba(OH)2 1,19M. Kết quả thấy bình 1 tăng 56,16 gam, còn ở bình 2 thì thu được 394 gam kết tủa. Giả thiết các phản ứng xảy ra hoàn toàn và các thể tích khí đều đo ở điều kiện tiêu chuẩn.
Xác định công thức phân tử của 2 hiđrocacbon và tính phần trăm khối lượng của 2 hiđrocacbon đó trong hỗn hợp Z.
K
Khách
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.
Những câu hỏi liên quan

5 tháng 12 2019
Đáp án D
Ta có nC2H2 = 0,15 mol, nH2 = 0,3 mol
Ta có mX = mY = mbình tăng + mZ
→ 0,15. 26 + 0,3. 2 = 3 + mZ → mZ = 1,5 gam
→ nZ =
1
,
5
5
3
.
4
= 0,225 mol → V= 5,04 lít.

12 tháng 10 2019
Đáp án : A
Hỗn hợp X có : 0,2 mol C2H2 ; 0,1 mol C3H6 ; 0,3 mol H2
Bảo toàn khối lượng : mX = mY = 10g
MY : MX = 12 : 7 => nX : nY = 12 : 7
=> nY = 0,35 mol => nH2 pứ = 0,25 mol
Có npi (X) = 2nC2H2 + nC3H6 = 0,5 mol => nPi(Y) = npi (X) – nH2 pứ = 0,25 mol
Y phản ứng được với AgNO3/NH3 => nAg2C2 = nC2H2 = 0,05 mol
=> npi (Z) = npi(Y) – 2nC2H2 (Y) = 0,15 mol
=> nBr2 = npi (Z) = 0,15 mol => m = 24g


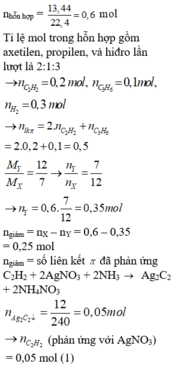

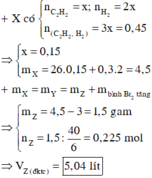
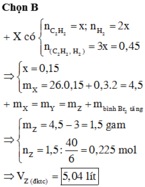
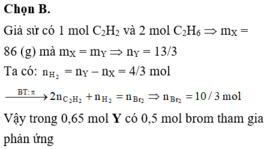


Gọi: \(\left\{{}\begin{matrix}n_{C_3H_8}=a\left(mol\right)\\n_{C_xH_y}=2a\left(mol\right)\\n_{C_xH_{2x}}=3a\left(mol\right)\end{matrix}\right.\) (trong 16,128 (l))
\(\Rightarrow a+2a+3a=\dfrac{16,128}{22,4}=0,72\left(mol\right)\Rightarrow a=0,12\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}n_{C_3H_8}=0,12\left(mol\right)\\n_{C_xH_y}=0,24\left(mol\right)\\n_{C_xH_{2x}}=0,36\left(mol\right)\end{matrix}\right.\)
Ta có: m bình 1 tăng = mH2O \(\Rightarrow n_{H_2O}=\dfrac{56,16}{18}=3,12\left(mol\right)\)
BTNT H, có: 0,12.8 + 0,24y + 0,36.2x = 3,12.2 (1)
Ta có: \(n_{Ba\left(OH\right)_2}=2.1,19=2,38\left(mol\right)\), \(n_{BaCO_3}=\dfrac{394}{197}=2\left(mol\right)\)
BTNT Ba, có: \(n_{Ba\left(HCO_3\right)_2}=2,38-2=0,38\left(mol\right)\)
BTNT C, có: 0,12.3 + 0,24.x + 0,36.x = nCO2 = nBaCO3 + 2nBa(HCO3)2 = 2 + 0,38.2 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=4\\y=10\end{matrix}\right.\)
Vậy: CTPT cần tìm là C4H10 và C4H8.
Hỗn hợp T gồm 2 hidrocacbon → T gồm C3H8 và C4H10.
→ Chỉ C4H8 pư với Br2.
Ta có: \(n_{C_4H_8}=n_{Br_2}=0,18\left(mol\right)\)
\(\Rightarrow n_{C_3H_8}=\dfrac{0,18}{3}=0,06\left(mol\right)\)
\(n_{C_4H_{10}}=\dfrac{0,18}{3}.2=0,12\left(mol\right)\)
⇒ mZ = mC3H8 + mC4H10 + mC4H8 = 0,06.44 + 0,12.58 + 0,18.56 = 19,68 (g)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{C_3H_8}=\dfrac{0,06.44}{19,68}.100\%\approx13,41\%\\\%m_{C_4H_{10}}=\dfrac{0,12.58}{19,68}.100\%\approx35,37\%\%\\\%m_{C_4H_8}\approx51,22\%\end{matrix}\right.\)