Cho 6,4 gam đất đèn (chứa 80% CaC2 và 20% còn lại là tạp chất trơ) vào nước dư. Thể tích khí thu được (đktc)
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án : D
CaCO3.MgCO3 à 2CO2
0,25 ß 0,5 mol
=>m= 0 , 25 . ( 100 + 84 ) . 100 80 = 57 , 5 g

X gồm O2 dư và CO2
CO2+ Ca(OH)2 -> CaCO3+ H2O
nCaCO3= nCO2= 0,08 mol
nX= 0,1 mol
=> nO2 dư= 0,02 mol
C+ O2 ⟶ CO2
=> nC= nO2 phản ứng= nCO2= 0,08 mol
Tổng nO2= 0,08+0,02= 0,1 mol
=> V= 2,24l
mC= 0,08.12= 0,96g
Than chứa 96% C nên lượng than đem đốt là 0,96:96%= 1g
Pt thứ 2 có nhiệt độ nha bn:)

nCaCO3 = 4,5/100 = 0,045 (mol)
PTHH:
CO2 + Ca(OH)2 -> CaCO3 + H2O
0,045 <--- 0,045 <--- 0,045
2C2H2 + 5O2 -> (t°) 4CO2 + 2H2O
0,0225 <--- 0,05625 <--- 0,045
VC2H2 = 0,0225 . 22,4 = 0,504 (l) = 504 (ml)
PTHH: CaC2 + 2H2O -> C2H2 + Ca(OH)2
nC2H2 (LT) = 0,504 : 80% = 0,63 (mol)
nCaC2 = 0,63 (mol)
mCaC2 = 0,63 . 64 = 40,32 (g)

CaC2 + 2H2O → Ca(OH)2 + C2H2
Ta có: nCaC2 = nC2H2 = 0,8 mol → mCaC2 = 0,8.64 = 51,2 gam
Do đất đèn chứa 80% CaC2 nên khối lượng đất đèn đã dùng là mđất đèn = 51,2.100/80 = 64 gam
\(n_{C_2H_2}=\dfrac{V}{22,4}=\dfrac{17,92}{22,4}=0,8mol\)
\(CaC_2+2H_2O\rightarrow C_2H_2+Ca\left(OH\right)_2\)
0,8 0,8 ( mol )
\(m_{CaC_2}=0,8.64.100:80=64g\)

Đáp án C
![]()
Vì ![]() nên chỉ có hai trường hợp là SO2 thiếu hoặc phản ứng tạo hai muối. Đề bài yêu cầu tìm giá trị lớn nhất của m nên khi cho SO2 vào dung dịch X sẽ tạo hai muối
H
S
O
-
3
và
S
O
2
-
3
nên chỉ có hai trường hợp là SO2 thiếu hoặc phản ứng tạo hai muối. Đề bài yêu cầu tìm giá trị lớn nhất của m nên khi cho SO2 vào dung dịch X sẽ tạo hai muối
H
S
O
-
3
và
S
O
2
-
3
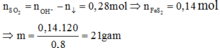

Đáp án C
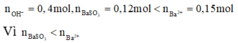
nên chỉ có hai trường hợp là SO2 thiếu hoặc phản ứng tạo hai muối. Đề bài yêu cầu tìm giá trị lớn nhất của m nên khi cho SO2 vào dung dịch


a, PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
Theo PT: \(n_{H_2}=n_{Zn}=0,2\left(mol\right)\Rightarrow V_{H_2}=0,2.22,4=4,48\left(l\right)\)
b, \(n_{Fe_2O_3}=\dfrac{6,4}{160}=0,04\left(mol\right)\)
PT: \(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
Xét tỉ lệ: \(\dfrac{0,04}{1}< \dfrac{0,2}{3}\), ta được H2 dư.
Theo PT: \(n_{H_2\left(pư\right)}=3n_{Fe_2O_3}=0,12\left(mol\right)\Rightarrow n_{H_2\left(dư\right)}=0,2-0,12=0,08\left(mol\right)\)
\(\Rightarrow m_{H_2\left(dư\right)}=0,08.2=0,16\left(g\right)\)
Theo PT: \(n_{Fe}=2n_{Fe_2O_3}=0,08\left(mol\right)\Rightarrow m_{Fe}=0,08.56=4,48\left(g\right)\)

a. nH2 = nFe = 0,1mol
Bảo toàn nguyên tố Fe => nFe2O3 = 0,05mol
=> mFe2O3 = 8g
=> %Fe2O3 = (8:10) . 100% = 80%
Ta có: mCaC2 = 6,4.80% = 5,12 (g)
\(\Rightarrow n_{CaC_2}=\dfrac{5,12}{64}=0,08\left(mol\right)\)
PT: \(CaC_2+2H_2O\rightarrow Ca\left(OH\right)_2+C_2H_2\)
Theo PT: \(n_{C_2H_2}=n_{CaC_2}=0,08\left(mol\right)\Rightarrow V_{C_2H_2}=0,08.22,4=1,792\left(l\right)\)