M là một quặng sắt chứa 60% Fe2O3, N là một quặng sắt khác chứa 69,6% Fe3O4 trộn quặng M với N theo tỉ lệ khối lượng mM : mN = 2 : 5 ta được quặng C. Hỏi 1 tấn quặng C chứa bao nhiêu kg sắt
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Bạn xem lời giải ở đây nhé.
https://olm.vn/hoi-dap/detail/7712766586263.html

%mFe ( trong A ) =
=> mFe ( trong A ) =
Vậy trong 1 tấn quặng A có chứa 420 kg Fe
%mFe ( trong B ) =
=> mFe ( trong B ) =
Vậy trong 1 tấn quặng B có chứa 504 kg Fe
%mFe2O3 =
%mFe3O4 =
=> mFe( quặng A trong C ) =
mFe ( quặng B trong C ) =
=> mFe ( trong C ) = 126 + 352,8 = 478,8 (kg)

Câu 1 :
mFe2O3 ( A ) = 0.6 tấn
mFe = (0.6/160)*112= 0.42 tấn
mFe3O4 ( B) = 0.696 tấn
mFe ( 0.696/232)*168= 0.504 tấn
=> Quặng B chứa nhiều sắt hơn
m = 0.504 - 0.42 = 0.084 tấn
Câu 2 :
Chọn tỉ lệ là : 2, 5
Trộn 2 tấn quặng A với 5 tấn quặng B thu được 7 tấn quặng C :
mFe ( C) = 2*0.42 + 5*0.504=3.36 tấn
Vậy trong 1 tấn quặng C có : 3.36/7 = 0.48 tấn

%mFe ( trong A ) = \(\frac{112}{160}.60=42\%\)
=> mFe ( trong A ) = \(\frac{42}{100}.1=0,42\left(\text{tấn}\right)=420\left(kg\right)\)
Vậy trong 1 tấn quặng A có chứa 420 kg Fe
%mFe ( trong B ) = \(\frac{168}{232}.69,6=50,4\%\)
=> mFe ( trong B ) = \(\frac{50,4}{100}.1=0,504\left(\text{tấn}\right)=504\left(kg\right)\)
Vậy trong 1 tấn quặng B có chứa 504 kg Fe
%mFe2O3 = \(\frac{3}{10}.100=30\%\)
%mFe3O4 = \(\frac{7}{10}.100=70\%\)
=> mFe( quặng A trong C ) = \(\frac{30.420}{100}=126\left(kg\right)\)
mFe ( quặng B trong C ) =\(\frac{70.504}{100}=352,8\left(kg\right)\)
=> mFe ( trong C ) = 126 + 352,8 = 478,8 (kg)

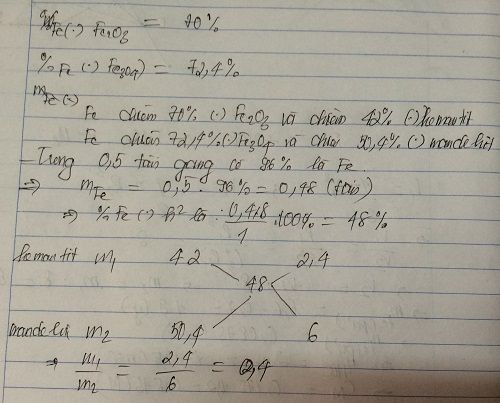
đề sai sai nha !
X là quặng hematit chứa 60% Fe2O3, Y là quặng manhetit chứa 69,6% Fe3O4. Cần trộn X, Y theo tỉ lệ khối lượng như thế nào để được quặng Z mà từ 1 tấn quặng Z có thể điều chế được 0,5 tấn gang chứa 96% sắt?OK!
Ta có: \(\dfrac{m_M}{m_N}=\dfrac{2}{5}\Rightarrow5m_M-2m_N=0\left(1\right)\)
Mà: mM + mN = 1 (tấn) = 1000 (kg) (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}m_M=\dfrac{2000}{7}\left(kg\right)\\m_N=\dfrac{5000}{7}\left(kg\right)\end{matrix}\right.\)
\(\Rightarrow m_{Fe_2O_3}=m_M.60\%=\dfrac{1200}{7}\left(kg\right)\Rightarrow n_{Fe_2O_3}=\dfrac{\dfrac{1200}{7}}{160}=\dfrac{15}{14}\left(kmol\right)\)
\(\Rightarrow n_{Fe}=2n_{Fe_2O_3}=\dfrac{15}{7}\left(kmol\right)\)
\(m_{Fe_3O_4}=m_N.69,6\%=\dfrac{3480}{7}\left(kg\right)\Rightarrow n_{Fe_3O_4}=\dfrac{\dfrac{3480}{7}}{232}=\dfrac{15}{7}\left(kmol\right)\)
\(\Rightarrow n_{Fe}=3n_{Fe_3O_4}=\dfrac{45}{7}\left(kmol\right)\)
\(\Rightarrow m_{Fe}=\left(\dfrac{15}{7}+\dfrac{45}{7}\right).56=480\left(kg\right)\)