Câu 3: Cho 5,6 lít hỗn hợp metan và etilen (đo ở đktc) đi qua dung dịch brom, người ta thu được 4,7 gam đibrometan (C2H4Br2).
a. Viết phương trình hóa học.
b. Tính thể tích của mỗi khí trong hỗn hợp ban đầu
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Bài 14 :
Vì metan không tác dụng với Brom nên :
\(n_{C2H4Br2}=\dfrac{4,7}{188}=0,025\left(mol\right)\)
a) Pt : \(C_2H_4+Br_2\rightarrow C_2H_4Br_{2|}\)
1 1 1
0,025 0,025
b) \(n_{C2H4}=\dfrac{0,025.1}{1}=0,025\left(mol\right)\)
\(V_{C2H4\left(dktc\right)}=0,025.22,4=0,56\left(l\right)\)
\(V_{CH4\left(dktc\right)}=1,4-0,56=0,84\left(l\right)\)
0/0VCH4 = \(\dfrac{0,84.100}{1,4}=60\)0/0
0/0VC2H4 = \(\dfrac{0,56.100}{1,4}=40\)0/0
Chúc bạn học tốt

Ta có:
nhh = 0,125(mol)
=> nC2H4Br2 = 4,7/188 = 0,025(mol)
C2H4 + Br2 => C2H4Br2
0,025_______0,025__________
=> nCH4 = 0,125-0,025 = 0,1(mol)
=> %VCH4 = 0,1.100/0,125 = 80%

nC2H4Br2 = \(\dfrac{4,7}{188}\)=0,025(mol)
C2H4 + Br2 -> C2H4Br2
0,025 <-----------0,025
=>VC2H4 = 0,025 . 22,4=0,56(l)
=> VCH4 = 2,8 - 0,56 =2,24 (l)
%VCH4 =\(\dfrac{2,24.100}{2,8}\)=80%
%VC2H4 = 100 % -80% = 20%
Bài 9 :
Metan không tác dụng với dung dịch Brom nên :
\(n_{C2H4Br2}=\dfrac{4,7}{188}=0,025\left(mol\right)\)
a) Pt : \(C_2H_4+Br_2\rightarrow C_2H_4Br_2|\)
1 1 1
0,025 0,025
b) \(n_{C2H4}=\dfrac{0,025.1}{1}=0,025\left(mol\right)\)
\(V_{C2H4\left(dktc\right)}=0,025.22,4=0,56\left(l\right)\)
\(\%V_{C2H4}=\dfrac{0,56.100}{2,8}=20\%\)
\(\%V_{CH4}=100\%-20\%=80\%\)
Chúc bạn học tốt

\(n_{hh}=\dfrac{6,72}{22,4}=0,3mol\)
\(n_{C_2H_4Br_2}=\dfrac{16}{188}=\dfrac{4}{47}mol\)
\(\Rightarrow n_{etilen}=\dfrac{4}{47}mol\)
\(\Rightarrow n_{metan}=0,3-\dfrac{4}{47}=\dfrac{101}{470}mol\)
\(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
\(\%V_{etilen}=\dfrac{\dfrac{4}{47}}{0,3}\cdot100\%=28,37\%\)
\(\%V_{metan}=100\%-28,37\%=71,63\%\)

1. \(n_{Br_2}=0,4.0,5=0,2\left(mol\right)\)
PT: \(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
Theo PT: \(n_{C_2H_4}=n_{Br_2}=0,2\left(mol\right)\Rightarrow V_{C_2H_4}=0,2.22,4=4,48\left(l\right)\)
2. \(n_{C_2H_4Br_2}=\dfrac{9,4}{188}=0,05\left(mol\right)\)
PT: \(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
Theo PT: \(n_{C_2H_4}=n_{C_2H_4Br_2}=0,05\left(mol\right)\)
\(\Rightarrow\%V_{C_2H_4}=\dfrac{0,05.22,4}{1,4}.100\%=80\%\)
\(\Rightarrow\%V_{CH_4}=100-80=20\%\)

\(m_{Br_2}=80g\Rightarrow n_{Br_2}=0,5mol\)
\(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
0,5 0,5
\(n_{hh}=\dfrac{28}{22,4}=1,25mol\)
\(\Rightarrow n_{CH_4}=1,25-0,5=0,75mol\)
\(\%V_{CH_4}=\dfrac{0,75}{1,25}\cdot100\%=60\%\)
\(\%V_{C_2H_4}=100\%-60\%=40\%\)

Dẫn 2 khí qua dung dịch nước brom chỉ có C 2 H 4 phản ứng
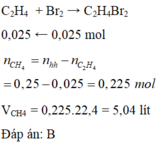
a) \(n_{C_2H_4Br_2}=\dfrac{4,7}{188}=0,025\left(mol\right)\)
PTHH: \(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
0,025<------------0,025
b) \(\left\{{}\begin{matrix}V_{C_2H_4}=0,025.22,4=0,56\left(l\right)\\V_{CH_4}=5,6-0,56=5,04\left(l\right)\end{matrix}\right.\)