Câu 3: Khử hoàn toàn 23,2 g một oxit sắt cần dùng 8,96 lít H2 ở điều kiện tiêu chuẩn.
a) Viết phương trình hóa học xảy ra. b) Xác định công thức hóa học của oxit sắt đó.Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


n oxit kim loại = 116 : 232 = 0,5 mol
n H2 = 44,8 : 22,4 = 2 mol
Gọi CTHH của oxit kl là: R\(_2O_n\)
có:
\(R_2O_n+nH_2\rightarrow2R+nH_2O\)
0,5 2
có:
2 = 0,5n
=> n = 4
Vậy CTHH của oxit kim loại là Fe3O4

\(n_{Fe}=\dfrac{33.6}{56}=0.6\left(mol\right)\)
\(Fe_2O_3+3H_2\underrightarrow{^{^{t^0}}}2Fe+3H_2O\)
\(0.3..........0.9......0.6\)
\(m_{Fe_2O_3}=0.3\cdot160=48\left(g\right)\)
\(V_{H_2}=0.9\cdot22.4=20.16\left(l\right)\)

\(m_{Cu}=12g\Rightarrow n_{Cu}=\dfrac{12}{64}=0,1875mol\)
\(\Rightarrow m_{Fe}=m_{kl}-m_{Cu}=24-12=12g\Rightarrow n_{Fe}=\dfrac{3}{14}mol\)
\(CuO+H_2\rightarrow Cu+H_2O\)
\(\dfrac{12}{64}\) \(\dfrac{12}{64}\)
\(Fe_2O_3+3H_2\rightarrow2Fe+3H_2O\)
\(\dfrac{9}{28}\) \(\dfrac{3}{14}\)
\(\Rightarrow\Sigma n_{H_2}=\dfrac{12}{64}+\dfrac{9}{28}=\dfrac{57}{112}mol\)
\(\Rightarrow V_{H_2}=\dfrac{57}{112}\cdot22,4=11,4l\)

a) Fe2O3 + 3H2 --to--> 2Fe + 3H2O
b) \(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
PTHH: Fe2O3 + 3H2 --to--> 2Fe + 3H2O
0,1<---0,3<-----0,2
=> mFe2O3 = 0,1.160 = 16 (g)
c) VH2 = 0,3.22,4 = 6,72 (l)

Ta có: \(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
a, PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
______0,2_________________0,2 (mol)
b, VH2 = 0,2.22,4 = 4,48 (l)
c, Ta có: \(n_{FeO}=\dfrac{7,2}{72}=0,1\left(mol\right)\)
PT: \(FeO+H_2\underrightarrow{t^o}Fe+H_2O\)
Xét tỉ lệ: \(\dfrac{0,1}{1}< \dfrac{0,2}{1}\), ta được H2 dư.
Theo PT: \(n_{Fe}=n_{FeO}=0,1\left(mol\right)\)
⇒ mFe = 0,1.56 = 5,6 (g)
Bạn tham khảo nhé!
a) Zn + 2HCl \(\rightarrow\)ZnCl2 + H2
b) mZn = \(\dfrac{13}{65}\)=0,2 (mol)
Zn + 2HCl \(\rightarrow\)ZnCl2 + H2
(mol) 0,2 ----------------------> 0,2
\(V_{H_2}\)= 0,2 . 22,4 = 4,48(lít)
c)\(n_{FeO}\)=\(\dfrac{7,2}{72}\)=0,1 (mol)
H2 + FeO \(\underrightarrow{t^o}\)Fe + H2O
(mol) 0,1----->0,1
mFe = 0,1 . 56 = 5,6(g)

\(n_{H_2thuđược}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
\(n_{H_2cầndùng}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\)
Ta có : Số mol Oxi/Oxit = n H2 dùng = 0,6 ( mol )
\(m_{\dfrac{O}{Oxit}}=0,6.16=9,6\left(g\right)\)
\(m_{\dfrac{M}{Oxit}}=32-9,6=22,4\left(g\right)\)
Gọi hóa trị M là n
PTHH :
\(2M+2nHCl\rightarrow2MCl_2+nH_2\uparrow\)
\(\dfrac{2}{n}.0,4\) 0,4
\(M_M=\dfrac{22,4}{\dfrac{2}{n}.0,4}=28.n\)
| n | 1 | 2 | 3 |
| M | 28 | 56 | 84 |
| Dk | (L) | T/M (Fe) | (L) |
Vậy kim loại M là Fe
\(\rightarrow\dfrac{n_{Fe}}{n_O}=\dfrac{\dfrac{22,4}{56}}{0,6}=\dfrac{2}{3}\)
Vậy CTPT của Oxit kim loại M là Fe2O3 .
Gọi hoá trị M là x nhưng mình làm lộn thành n , bạn đổi lại x thành n nha

\(CT:Fe_xO_y\)
\(Fe_xO_y+yH_2\underrightarrow{^{t^o}}xFe+yH_2O\left(1\right)\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\left(2\right)\)
\(n_{Fe}=n_{H_2\left(2\right)}=\dfrac{4.032}{22.4}=0.18\left(mol\right)\)
\(n_{H_2\left(1\right)}=\dfrac{y}{x}\cdot n_{Fe}=\dfrac{5.376}{22.4}=0.24\left(mol\right)\)
\(\Leftrightarrow\dfrac{y}{x}\cdot0.18=0.24\)
\(\Leftrightarrow\dfrac{x}{y}=\dfrac{3}{4}\)
\(CT:Fe_3O_4\)
\(m_{Fe_3O_4}=\dfrac{0.18}{3}\cdot232=13.92\left(g\right)\)
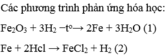
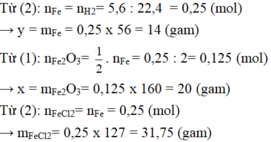

a) Gọi CTHH của oxit sắt là FexOy (x,y nguyên dương)
\(Fe_xO_y+yH_2\xrightarrow[]{t^o}xFe+yH_2O\)
b) \(n_{H_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
Theo PT: \(n_{Fe_xO_y}=\dfrac{1}{y}.n_{H_2}=\dfrac{0,4}{y}\left(mol\right)\)
\(\Rightarrow M_{Fe_xO_y}=\dfrac{23,2}{\dfrac{0,4}{y}}=58y\left(g/mol\right)\)
\(\Rightarrow56x+16y=58y\\ \Leftrightarrow\dfrac{x}{y}=\dfrac{3}{4}\)
Vậy CTHH của oxi sắt là Fe3O4