Cho 2,44 gam hỗn hợp A gồm 3 kim loại Mg , Fe , và Cu ( ở dạng bột ) vào dung dịch loãng có chứa 0,05 mol H2SO4 . Sau khi phản ứng xảy ra hoàn toàn , thấy thoát ra 0,784 lít khí H2 ( đktc) và hỗn hợp B . Đem lọc , rửa B thu được 1,28 gam chất rắn
a, Viết phương trình các phản ứng xảy ra .
b, Tính % khôid lượng mỗi kim loại có trong hỗn hợp A

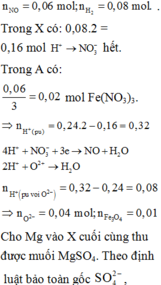
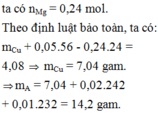
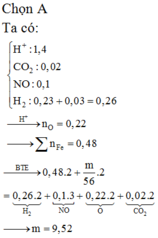
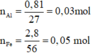
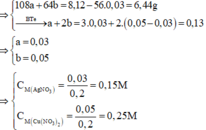


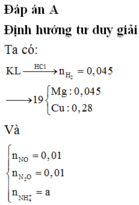
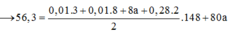
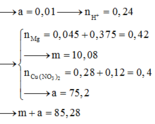

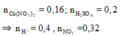
a)
$Mg + H_2SO_4 \to MgSO_4 + H_2$
$Fe + H_2SO_4 \to FeSO_4 + H_2$
b) Chất rắn không tan là Cu $\Rightarrow m_{Cu} = 1,28(gam)$
Gọi $n_{Mg} = a(mol) ; n_{Fe} = b(mol) \Rightarrow 24a + 56b + 1,28 = 2,44(1)$
Theo PTHH :
$n_{H_2} = a + b = \dfrac{0,784}{22,4} = 0,035(2)$
Từ (1)(2) suy ra : a = 0,025 ; b = 0,01
$\%m_{Mg} = \dfrac{0,025.24}{2,44}.100\% = 24,6\%$
$\%m_{Fe} = \dfrac{0,01.56}{2,44}.100\% = 23\%$
$\%m_{Cu} = 100\% - 24,6\% - 23\% = 52,4\%$