Đốt cháy hoàn toàn x gam hỗn hợp FeS2 và FeCO3 với số mol bằng nhau trong không khí dư, thu được y gam chất rắn. Viết các phương trình phản ứng xảy ra và tính giá trị x:y?
K
Khách
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Những câu hỏi liên quan

5 tháng 10 2017
Đáp án B
nFeS2 = nAg2S =1/3 nSO2 = 0,055 mol
Chất rắn B gồm có Fe2O3 và Ag, cho qua H2SO4 thì chỉ còn lại Ag
⇒m=0,055 . 2 .108 = 11,88
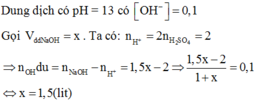
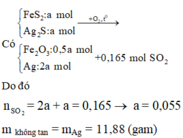
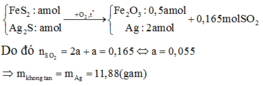
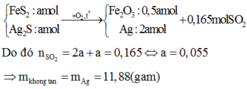


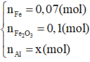
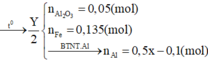
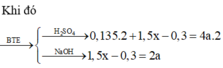
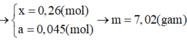
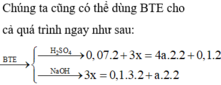
\(n_{FeS_2}=\dfrac{x}{2.120}=\dfrac{x}{240}\left(mol\right)\\ n_{FeCO_3}=\dfrac{x}{2.116}=\dfrac{x}{232}\left(mol\right)\\ 4FeS_2+11O_2\rightarrow\left(t^o,xt\right)2Fe_2O_3+8SO_2\\ 4FeCO_3+O_2\rightarrow\left(t^o\right)2Fe_2O_3+4CO_2\\ \Rightarrow y=m_{Fe_2O_3}=\dfrac{x}{240.2}.160+\dfrac{x}{232.2}.160=\dfrac{59}{87}x\left(g\right)\\ \Rightarrow\dfrac{x}{y}=\dfrac{87}{59}\)
nFeS2=x2.120=x240(mol)nFeCO3=x2.116=x232(mol)4FeS2+11O2→(to,xt)2Fe2O3+8SO24FeCO3+O2→(to)2Fe2O3+4CO2⇒y=mFe2O3=x240.2.160+x232.2.160=5987x(g)⇒xy=8759