Đốt cháy hoàn toàn 5,4 g kim loại nhôm Al trong khí oxi. a. Tính thể tích khí oxi (đktc) cần dùng cho phản ứng. b. Tính khối lượng KClO3 cần dùng để điều chế lượng oxi trên.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a.\(n_{Al_2O_3}=\dfrac{30,6}{102}=0,3mol\)
\(4Al+3O_2\rightarrow\left(t^o\right)2Al_2O_3\)
0,6 0,45 0,3 ( mol )
\(m_{Al}=0,6.27=16,2g\)
\(V_{O_2}=0,45.22,4=10,08l\)
\(V_{kk}=10,08.5=50,4l\)
b.\(2KClO_3\rightarrow\left(t^o,MnO_2\right)2KCl+3O_2\)
0,3 0,45 ( mol )
\(m_{KClO_3}=0,3.122,5=36,75g\)
c.\(2KClO_3\rightarrow\left(t^o,MnO_2\right)2KCl+3O_2\)
0,3 0,45 ( mol )
\(n_{KClO_3}=\dfrac{0,3}{75\%}=0,4mol\)
\(m_{KClO_3}=0,4.122,5=49g\)

nAl=16,2/27= 0,6(mol)
a) PTHH: 4 Al +3 O2 -to-> 2 Al2O3
nO2= 3/4 . nAl=3/4 . 0,6= 0,45(mol)
=> V(O2,đktc)=0,45 x 22,4=10,08(l)
b) nAl2O3= nAl/2=0,6/2=0,3(mol)
=>mAl2O3=102. 0,3= 30,6(g)
c) 2KMnO4 -to-> K2MnO4 + MnO2 + O2
nKMnO4= 2.nO2=2. 0,45=0,9(mol)
=>mKMnO4= 158 x 0,9= 142,2(g)

Theo gt ta có: $n_{H_2}=0,75(mol)$
a, $2H_2+O_2\rightarrow 2H_2O$
Ta có: $n_{O_2}=0,5.n_{H_2}=0,375(mol)\Rightarrow V_{O_2}=8,4(l)\Rightarrow V_{kk}=42(l)$
b, $2KMnO_4\rightarrow K_2MnO_4+MnO_2+O_2$
Ta có: $n_{KMnO_4}=2.n_{O_2}=0,75(mol)\Rightarrow m_{KMnO_4}=118,5(g)$
a)
\(2H_2 + O_2 \xrightarrow{t^o} 2H_2O\\ V_{O_2} = \dfrac{V_{H_2}}{2} = \dfrac{16,8}{2} = 8,4(lít)\\ V_{không\ khí} = \dfrac{8,4}{20\%} = 42(lít)\)
b)
\(n_{O_2} = \dfrac{8,4}{22,4} = 0,375(mol)\\ 2KMnO_4 \xrightarrow{t^o} K_2MnO_4 + MnO_2 + O_2\\ n_{KMnO_4} = 2n_{O_2} = 0,75(mol)\\ \Rightarrow m_{KMnO_4} = 0,75.158 = 118,5(gam)\\ 2KClO_3 \xrightarrow{t^o} 2KCl + 3O_2\\ n_{KClO_3} = \dfrac{2}{3}n_{O_2} = 0,25(mol)\\ \Rightarrow m_{KClO_3} = 0,25.122,5 = 30,625(gam)\)

Bạn tách ra từng câu nhé!
Bài 3.
\(n_{Fe}=\dfrac{m_{Fe}}{M_{Fe}}=\dfrac{36}{56}=0,6428mol\)
\(3Fe+2O_2\rightarrow\left(t^o\right)Fe_3O_4\)
0,6428 ----- 0,4285 ( mol )
\(2KMnO_4\rightarrow\left(t^o\right)K_2MnO_4+MnO_2+O_2\)
0,857 0,4285 ( mol )
\(m_{KMnO_4}=n_{KMnO_4}.M_{KMnO_4}=0,857.158=135,406g\)
Bài 4.
a.\(n_{Al_2O_3}=\dfrac{m_{Al_2O_3}}{M_{Al_2O_3}}=\dfrac{51}{102}=0,5mol\)
\(4Al+3O_2\rightarrow\left(t^o\right)2Al_2O_3\)
1 0,75 0,5 ( mol )
\(m_{Al}=n_{Al}.M_{Al}=1.27=27g\)
\(V_{O_2}=n_{O_2}.22,4=0,75.22,4=16,8l\)
b.\(2KMnO_4\rightarrow\left(t^o\right)K_2MnO_4+MnO_2+O_2\)
1,5 0,75 ( mol )
\(m_{KMnO_4}=n_{KMnO_4}.M_{KMnO_4}=1,5.158=237g\)
\(2KClO_3\rightarrow\left(t^o\right)2KCl+3O_2\)
0,5 0,75 ( mol )
\(m_{KClO_3}=n_{KClO_3}.M_{KClO_3}=0,5.122,5=61,25g\)

nAl = 5,4/27 = 0,2 (mol)
PTHH: 4Al + 3O2 -> (t°) 2Al2O3
Mol: 0,2 ---> 0,15
VO2 = 0,15 . 22,4 = 3,36 (l)
PTHH: 2KMnO4 -> (t°) K2MnO4 + MnO2 + O2
nKMnO4 = 0,15 . 2 = 0,3 (mol)
mKMnO4 = 0,3 . 158 = 47,4 (g)

a)\(n_{Al}=\dfrac{21,6}{27}=0,8\left(m\right)\)
\(PTHH:4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
tỉ lệ :4 3 2
số mol :0,8 0,6 0,4
\(V_{O_2}=0,6.22,4=13,44\left(g\right)\)
b)\(m_{Al_2O_3}=0,4.102=40,8\left(g\right)\)
c)\(PTHH:2KClO_3\underrightarrow{t^o}2KCl+3O_2\)
tỉ lệ : 2 2 3
số mol :0,4 0,4 0,6
\(m_{KClO_3}=0,4.122,5=49\left(g\right)\)

a.b.\(n_{Mg}=\dfrac{m}{M}=\dfrac{6,4}{24}=\dfrac{4}{15}mol\)
\(2Mg+O_2\rightarrow\left(t^o\right)2MgO\)
4/15 2/15 ( mol )
\(V_{O_2}=n.22,4=\dfrac{2}{15}.22,4=\dfrac{224}{75}l\)
c.\(2KMnO_4\rightarrow\left(t^o\right)K_2MnO_4+MnO_2+O_2\)
4/15 2/15 ( mol )
\(m_{KMnO_4}=n.M=\dfrac{4}{15}.158=\dfrac{632}{15}g\)
nMg = 6,4 : 24= 0,26(mol)
pthh : 2Mg+O2 -t--> 2MgO
0,26 --> 0,13 (mol )
=> VO2(đktc) = 0,13.22,4=2,912(l)
pthh : 2KMnO4-t--> K2MnO4 + MnO2+ O2
0,26<------------------------------0,13(mol)
=> mKMnO4 = 0,26.158= 41,08(g)

nP = 3,1 : 31 = 0,1 (mol)
pthh : 4P + 5O2 -t--> 2P2O5 (1)
0,1--> 0,125 (mol)
=> VO2 = 0,125 .22,4 = 2,8(l)
pthh : 2KMnO4 -t--> K2MnO4 + MnO2 +O2 (2)
0,25<--------------------------- 0,125(mol)
=> mKMnO4 = 0,25 .158 = 39,5(g)
d ) (1) là Phản ứng hóa hợp
(2) là phản ứng phân hủy
nP = 3,1/31 = 0,1 (mol)
PTHH: 4P + 5O2 -> (t°) 2P2O5 (phản ứng hóa hợp)
Mol: 0,1 ---> 0,125
VO2 = 0,125 . 22,4 = 2,8 (l)
PTHH: 2KMnO4 -> (t°) K2MnO4 + MnO2 + O2 (phản ứng phân hủy)
nKMnO4 = 0,125 . 2 = 0,25 (mol)
mKMnO4 = 0,25 . 158 = 39,5 (g)



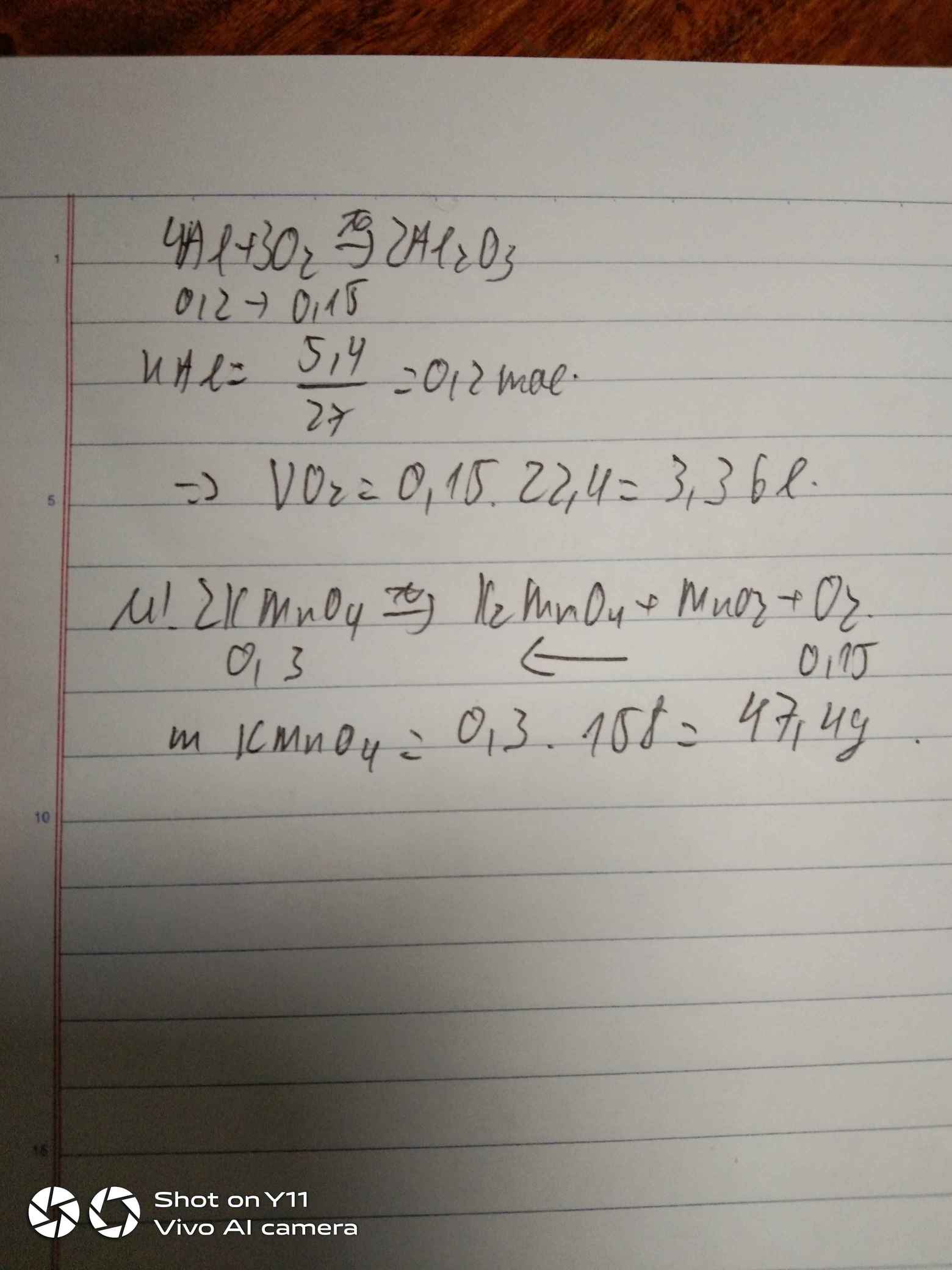

a) $n_{Al} = \dfrac{5,4}{27} = 0,2(mol)$
$4Al + 3O_2 \xrightarrow{t^o} 2Al_2O_3$
Theo PTHH : $n_{O_2} = \dfrac{3}{4}n_{Al} = 0,15(mol)$
$V_{O_2} = 0,15.22,4 = 3,36(lít)$
b) $2 KClO_3 \xrightarrow{t^o} 2KCl + 3O_2$
$n_{KClO_3} = \dfrac{2}{3}n_{O_2} = 0,1(mol)$
$m_{KClO_3} = 0,1.122,5 = 12,25(gam)$
\(n_{Al}=\dfrac{m}{M}=\dfrac{5,4}{27}=0,2\left(mol\right)\\ PTHH:4Al+3O_2-^{t^o}>2Al_2O_3\)
tỉ lệ: 4 : 3 : 2
n(mol) 0,2---->0,15---->0,1
\(V_{O_2\left(dktc\right)}=n\cdot22,4=0,15\cdot22,4=3,36\left(l\right)\\ PTHH:2KClO_3-^{t^o}>2KCl+3O_2\)
tỉ lệ: 2 : 2 : 3
n(mol) 0,1<-------------------------0,15
\(m_{KClO_3}=n\cdot M=0,1\cdot\left(39+35,5+16\cdot3\right)=12,25\left(g\right)\)