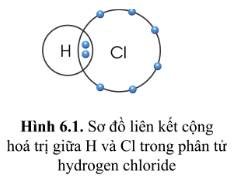
Quan sát hình 6.1, hãy so sánh hóa trị của nguyên tố và số electron mà nguyên tử của nguyên tố đã góp chung để tạo ra liên kết
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Các nguyên tố thuộc nhóm VIIA gồm các nguyên tố : flo (F), clo (Cl), brom (Br), iot (I), atatin (At). Nguyên tử của chúng có 7 electron hoá trị.
Khi hai nguyên tử của cùng một nguyên tố thuộc nhóm này liên kết với nhau tạo thành phân tử thì mỗi nguyên tử góp 1 electron, tạo thành một cặp electron chung tức là một liên kết, vì mỗi nguyên tử chỉ thiếu electron để đạt được cấu hình 8 electron vững bền (giống như của khí hiếm đứng sau nó).
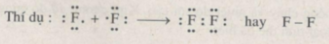

Chọn C
X là K (kim loại mạnh), Y là phi kim (phi kim mạnh)
Liên kết hóa học giữa X và Y là liên kết ion

Đáp án C
X là kim loại do có 1e lớp ngoài cùng, Y là phi kim do có 7e lớp ngoài cùng.X,Y là kim loại và phi kim điển hình, liên kết tạo thành là liên kết ion.

Đáp án A
X thuộc nhóm IA, kim loại kiềm tức kim loại điển hình, Y thuộc nhóm VII A, phi kim điển hình
Liên kết giữa X và Y là lk ion

X thuộc nhóm IA, kim loại kiềm tức kim loại điển hình, Y thuộc nhóm VII A, phi kim điển hình. Liên kết giữa X và Y là lk ion.
Đáp án A

C đúng.
Trong tất cả các hợp chất F chỉ có số oxi hóa -1 do F có độ âm điện lớn nhất.
Các nguyên tố halogen khác ngoài số oxi hóa -1 còn có các số oxi hóa +1; +3; +5; +7

So sánh tính chất hóa học của brom với clo và iot.
Brom có tính oxi hóa yếu hơn clo nhưng mạnh hơn iot nên:
Cl2 + 2NaBr → 2NaCl + Br2
Br2 + 2NaI → 2NaBr + I2.

| Nguyên tố | Si | O |
| Hóa trị | IV | II |
| Số nguyên tử | 1 | 2 |
| Tích hóa trị và số nguyên tử | IV x 1 II.2 |
=> Tích hóa trị và số nguyên tử của nguyên tố Si = tích hóa trị và số nguyên tử của nguyên tố O
Hóa trị của H và Cl đều là I, bằng với số electron mà nguyên tử H và Cl góp chung để tạo ra liên kết.