Quan sát Hình 18.2, giải thích nhiệt độ sôi cao bất thường của hydrogen fluorine so với các hydrogen halide còn lại. 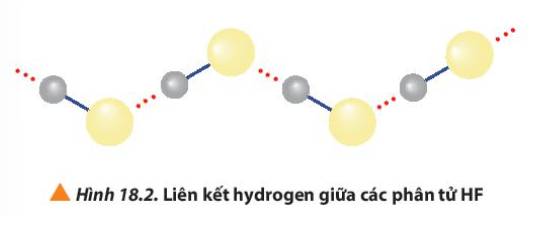
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Nhiệt độ sôi của hydrogen bromide cao hơn nhiệt độ sôi của hydrogen chloride được giải thích như sau:
+ Khối lượng phân tử HBr (81) cao hơn khối lượng phân tử HCl (36,5)
+ Br có bán kính nguyên tử lớn, có nhiều electron hơn Cl => Tăng khả năng lưỡng cực HX => Làm tăng tương tác van der Waals giữa các phân tử

- Ở điều kiện thường, nhiệt độ là 25oC, tất cả các hydrogen halide đều ở thể khí
=> Khi hạ nhiệt độ xuống thấp dần, hydrogen fluoride sẽ được hóa lỏng đầu tiên

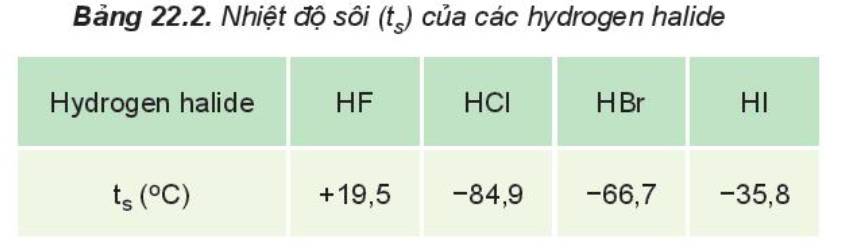
Từ Bảng 22.2 nhận thấy:
- HF lỏng có nhiệt độ sôi cao bất thường là do phân tử HF phân cực mạnh, có khả năng tạo liên kết hydrogen: H-F…H-F…H-F
- Từ HCl đến HI, nhiệt độ sôi tăng do:
+ Lực tương tác van der Waals giữa các phân tử tăng
+ Khối lượng phân tử tăng
nhiệt độ sôi tăng từ HI đến HF là do lực tương tác van der Waals giữa các phân tử tăng và khối lượng phân tử tăng.

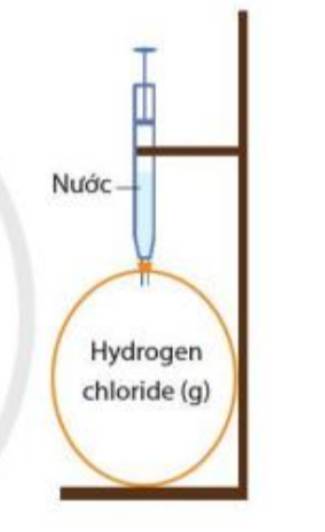
Khí hydrogen chloride tan nhiều trong nước tạo thành dung dịch hydrochloric acid
=> Khi bơm nước vào, khí hydrogen chloride bị hòa tan hết
=> Quả bóng bị xẹp vào

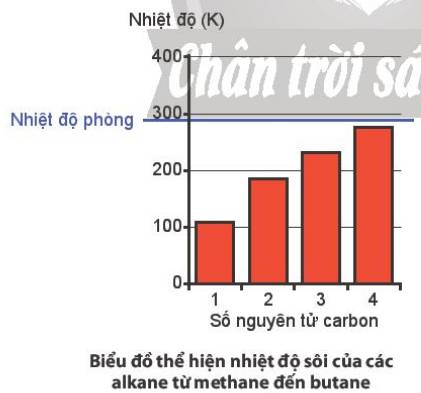
a, Nhiệt độ sôi tăng dần theo độ lớn của PTK
b, Ở nhiệt độ phòng, cả 4 chất này đều là chất khí.

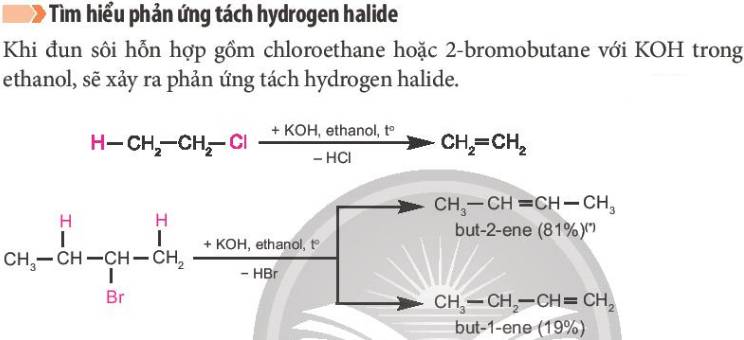
Trong phản ứng tách hydrogen halide, nguyên tử hydrogen ở nguyên tử carbon bên cạnh được tách cùng với nguyên tử halogen ra khỏi dẫn xuất.
Trong đó, nguyên tử halogen ưu tiên tách ra cùng với nguyên tử hydrogen ở nguyên tử carbon bên cạnh có bậc cao hơn, tạo ra sản phẩm chính.
(Nhìn sơ đồ trong hình là có thể thấy rõ, sp chính là sản phẩm có % tạo thành nhiều hơn so với sp phụ)
Trong phản ứng tách hydrogen halide, nguyên tử hydrogen ở nguyên tử carbon bên cạnh (carbon chứa halogen) được tách cùng với nguyên tử halogen ra khỏi dẫn xuất.
Nguyên tử halogen (X) ưu tiên tách ra cùng với nguyên tử hydrogen (H) ở nguyên tử carbon bên cạnh có bậc cao hơn, tạo ra sản phẩm chính (Quy tắc Zaitsev).

Nhiệt độ sôi của các hydrogen halide tăng dần từ HCl đến HI. Nguyên nhân là do khối lượng phân tử tăng, làm tăng năng lượng cần thiết cho quá trình sôi; đồng thời, sự tăng kích thước và số electron trong phân tử, dẫn đến tương tác van der Waals giữa các phân tử tăng
Nhiệt độ sôi tăng dần từ HCl đến HI
Giải thích:
-M tăng làm tăng năng lượng cần thiết cho quá trình sôi
-sự tăng kích thước và số electron trong phân tử dẫn đến tương tác van der Waals giữa các phân tử tăng.

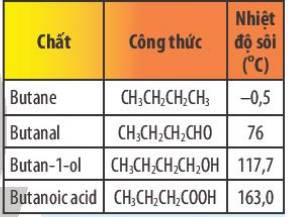
Nhiệt độ sôi: butanoic acid > butan – 1 – ol > butanal > butane.
Giải thích:
+ Vì Butanoic acid có nhiệt độ sôi cao nhất trong dãy do butanoic acid có khả năng tạo thành liên kết hydrogen bền vững hơn liên kết hydrogen trong phân tử butan – 1 – ol.
+ Butanal và butane không có liên kết hydrogen nhưng butanal phân cực nên có nhiệt độ sôi cao hơn butane.

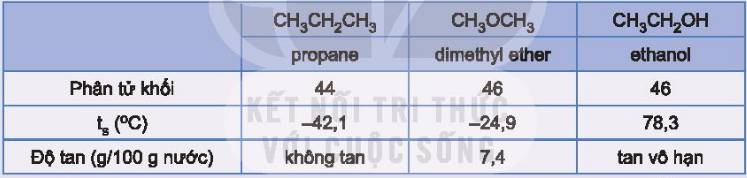
Do các phân tử ethanol có thể tạo liên kết hydrogen với nhau và với nước.


Các phân tử hydrogen fluoride hình thành liên kết phân tử, loại liên kết này bền hơn tương tác van der Waals, nên nhiệt độ sôi của hydrogen flouride cao bất thường với các hydrogen halide còn lại.