Bài 3:
a) Giải thích vì sao bán kính nguyên tử Na, Mg lớn hơn bán kính các ion kim loại tương ứng
b) Vì sao cả Na2O và MgO đều là chất rắn ở nhiệt độ thường?
c) Vì sao nhiệt độ nóng chảy của MgO (2 852oC) cao hơn rất nhiều so với Na2O (1 132oC)?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)
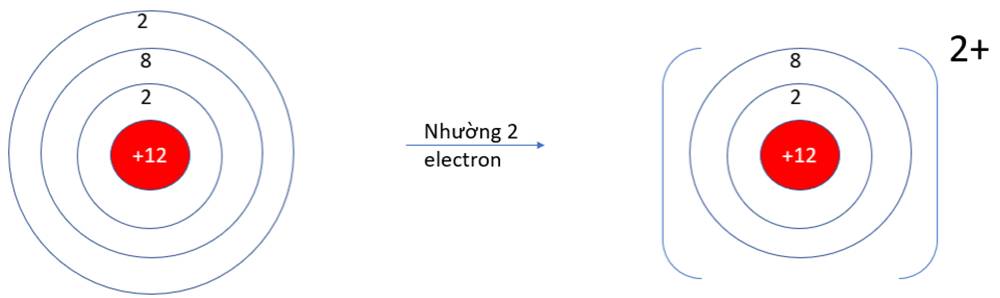
- Ở dạng nguyên tử, Na và Mg đều có 3 lớp electron. Ở dạng ion Na+, Mg2+ chỉ có 2 lớp electron
=> Bán kính nguyên tử Na, Mg lớn hơn bán kính các ion kim loại tương ứng
b, Mỗi nguyên tử Na đã nhường 1 electron, nguyên tử O nhận 2 electron từ nguyên tử Na để hình thành hợp chất ion Na2O.
2Na+ + O2- → Na2O
Vì Na2O là hợp chất ion nên ở điều kiện thường Na2O tồn tại ở thể rắn.
Nguyên tử Mg nhường 2 electron, nguyên tử O nhận 2 electron từ nguyên tử Mg để hình thành hợp chất ion MgO.
Mg2+ + O2- → MgO
Vì MgO là hợp chất ion nên ở điều kiện thường MgO tồn tại ở thể rắn.
c, Tá có:
+ Bán kính ion Na+ < bán kính ion Mg2+.
+ Điện tích ion Mg2+ < điện tích ion Na+.
Vậy nhiệt độ nóng chảy của MgO (2852oC) cao hơn rất nhiều so với Na2O (1132oC) do năng lượng phân li tỉ lệ thuận với điện tích ion và tỉ lệ nghịch với bán kính ion.

Đáp án B
(a) Đúng vì hình thành cặp điện cực Fe - C nên bề mặt gang bị ăn mòn điện hóa.
(b) Sai, Hg là kim loại duy nhất tồn tại ở trạng thái lỏng ở điều kiện thường.
(c) Đúng.
(d) Sai, còn phụ thuộc vào điện tích hạt nhân, số lớp e...
→ Có 2 phát biểu đúng.

1, đúng
2, đúng vì các kim loại kiềm ở nhóm IA có bán kính lớn nhất so với các kim loại khác cùng chu kì
3, đúng vì do các electron tự do trong kim loại kiềm gây ra
4, đúng vì vì các kim loại kiềm có nhiệt độ nóng chảy giảm dần từ Li đến Cs (SGK Hóa 12NC trang 150)
B đúng
Đáp án cần chọn là: D

Đáp án B
Các phát hiểu đúng là (4), (5)
(1) Sai vì theo chiều tăng dần điện tích hạt nhân, các kim loại kiềm thổ (từ Be đến Ba) có nhiệt độ nóng chảy giảm từ Be → Mg, tăng từ Mg → Ca, giảm từ Ca → Ba.
(2) Sai vì kim loại Cs được dùng để chế tạo tế bào quang điện do có năng lượng ion hóa nhỏ
(3) Sai vì mỗi kim loại kiềm thổ có mạng tinh thể đặc trưng riêng

Lực hút tĩnh điện giữa các ion ngược dấu trong tinh thể ion rất lớn. Các hợp chất ion đều khá rắn, khó bay hơn, khó nóng chảy.
a)
- Ở dạng nguyên tử, Na và Mg đều có 3 lớp electron. Ở dạng ion Na+, Mg2+ chỉ có 2 lớp electron
=> Bán kính nguyên tử Na, Mg lớn hơn bán kính các ion kim loại tương ứng
b, Mỗi nguyên tử Na đã nhường 1 electron, nguyên tử O nhận 2 electron từ nguyên tử Na để hình thành hợp chất ion Na2O.
2Na+ + O2- → Na2O
Vì Na2O là hợp chất ion nên ở điều kiện thường Na2O tồn tại ở thể rắn.
Nguyên tử Mg nhường 2 electron, nguyên tử O nhận 2 electron từ nguyên tử Mg để hình thành hợp chất ion MgO.
Mg2+ + O2- → MgO
Vì MgO là hợp chất ion nên ở điều kiện thường MgO tồn tại ở thể rắn.
c, Tá có:
+ Bán kính ion Na+ < bán kính ion Mg2+.
+ Điện tích ion Mg2+ < điện tích ion Na+.
Vậy nhiệt độ nóng chảy của MgO (2852oC) cao hơn rất nhiều so với Na2O (1132oC) do năng lượng phân li tỉ lệ thuận với điện tích ion và tỉ lệ nghịch với bán kính ion.