Hòa tan Al trong H2 SO4 thu được Al2 (SO4)3 ;H2O và 4,48 lít khí SO2 ở điều kiện tiêu chuẩn .Tính khối lượng của Al2(SO4)3
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{Al}=\dfrac{10.8}{27}=0.4\left(mol\right)\)
\(n_{H_2SO_4}=\dfrac{22.4}{98}=\dfrac{8}{35}\left(mol\right)\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
\(2............3\)
\(0.4..........\dfrac{8}{35}\)
\(LTL:\dfrac{0.4}{2}>\dfrac{\dfrac{8}{35}}{3}\Rightarrow Aldư\)
\(m_{Al\left(dư\right)}=\left(0.4-\dfrac{8}{35}\cdot\dfrac{2}{3}\right)\cdot27=6.68\left(g\right)\)
\(m_{Al_2\left(SO_4\right)_3}=\dfrac{8}{35\cdot3}\cdot342=26.05\left(g\right)\)
\(V_{H_2}=\dfrac{8}{35}\cdot22.4=5.12\left(l\right)\)

$a) 2Al + 3H_2SO_4 \to Al_2(SO_4)_3 + 3H_2$
$b) n_{Al} = \dfrac{10,8}{27} = 0,4(mol)$
Theo PTHH : $n_{H_2SO_4} = \dfrac{3}{2}n_{Al} = 0,6(mol)$
$m_{H_2SO_4} = 0,6.98 = 58,8(gam)$
$c) n_{Al_2(SO_4)_3} = \dfrac{1}{2}n_{Al} = 0,2(mol) \Rightarrow m_{Al_2(SO_4)_3} = 0,2.342 = 68,4(gam)$
$d) n_{H_2} = n_{H_2SO_4} = 0,6(mol) \Rightarrow V_{H_2} = 0,6.22,4 = 13,44(lít)$
\(a,2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
\(b.n_{Al}=\dfrac{m}{M}=0,4\left(mol\right)\)
\(Theo.PTHH\Rightarrow n_{H_2SO_4}=n_{H_2}=\dfrac{3}{2}n_{Al}=1,5.0,4=0,6\left(mol\right)\\ \Rightarrow m_{H_2SO_4}=n.M=0,6.98=58,8\left(g\right)\)
\(c,Theo.PTHH\Rightarrow n_{Al_2\left(SO_4\right)_3}=\dfrac{1}{2}n_{Al}=0,5.0,4=0,2\left(mol\right)\\ \Rightarrow m_{Al_2\left(SO_4\right)_3}=n.M=0,2.342=68,4\left(g\right)\\ d,V_{H_2\left(dktc\right)}=n.22,4=0,6.22,4=13,44\left(l\right)\)

\(Zn+2HCl->ZnCl_2+H_2\\ m_{Zn}=\dfrac{7,437}{24,79}\cdot65=19,5g\\ m_{HCl}=\dfrac{7,437}{24,79}\cdot2\cdot36,5=21,9g\)

Đáp án A
Các phương trình phản ứng:
Dung dịch H2SO4 20% thuộc loại dung dịch loãng.
Phương trình phản ứng:
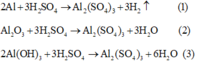
Do các chất tác dụng vừa đủ với nhau
=> dung dịch sau chỉ có chất tan là Al2(SO4)3.
Tính toán:
Ta có: n H 2 = 5 , 04 22 , 4 = 0 , 225 mol
Sơ đồ phản ứng:
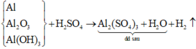
Khối lượng Al2(SO4)3 trong dung dịch sau là:
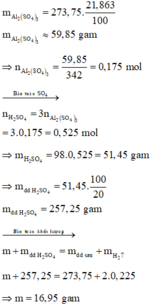

\(n_{Al}=\dfrac{5.4}{27}=0.2\left(mol\right)\\ n_{H_2SO_4}=\dfrac{49}{98}=0.5\left(mol\right)\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
\(Bđ:0.2..........0.5\)
\(Pư:0.2.........0.3..............0.1............0.3\)
\(Kt:0...........0.2...............0.1.............0.3\)
\(m_{Al_2\left(SO_4\right)_3}=0.1\cdot342=34.2\left(g\right)\)
\(V_{H_2}0.3\cdot22.4=6.72\left(l\right)\)

a) 3H2SO4 + 2Al ---> Al2(SO4)3 + 3H2
0,75 0,5 0,25 0,75 ( mol )
b) mAl = 0,5 . 27 =13,5 g
c) VH2= 0,75 . 22,4 = 16,8 l
d) mAl2(SO4)3 = 0,25 . 342 =85,5g
e) nAl = 0,5 mol
nH2 = 0,75 mol
a) PTHH: 2Al+ 3H2SO4 ----> Al2(SO4)3 + 3H2
0.5 0.75 0.25 0.75
b)mAl=0.5*27=13.5g
c)VH2=0.75*22.4=16.8 l
d)mAl2(SO4)3=0.25*342=85.5g
c)số mol của Al và H2 đã có trên PTHH
Chúc em học tốt!!!

Đáp án D
n H 2 = 0 , 13 m o l → n O H - = 0 , 26 m o l = 2 n B a + n N a
Đồng thời ta cũng giải được số mol Ba, Na lần lượt là 0,1 và 0,06 mol.
Ta có: m k e t t u a = 0 , 72 + 15 , 08 - 0 , 13 . 2 = 15 , 54 g a m
Trong X chứa 0,3a mol Al(NO3)3 và 0,2a mol Al2(SO4)3.
Giả sử số mol SO42- lớn hơn số mol Ba2+
suy ra ![]()
vậy kết tủa chứa BaSO4 0,1 mol.
→ m A l ( O H ) 3 < 0 vô lý
Vậy số mol SO42- nhỏ hơn số mol Ba2+ vậy kết tủa chứa 0,6a mol BaSO4
Số mol Al(OH)3 tối đa có thể tạo ra là 0,7a mol
→ n O H - k t m a x = 2 , 1 a < 0 , 2333
do vậy kết tủa có bị hòa tan một phần
→ n A l ( O H ) 3 = 4 n A l 3 + - n O H - = 2 , 8 a - 0 , 26
→ a = 1

Đáp án D
n H 2 = 0 , 13 m o l → n O H - = 0 , 26 m o l = 2 n B a + n N a
Đồng thời ta cũng giải được số mol Ba, Na lần lượt là 0,1 và 0,06 mol.
Ta có: m k ế t t ủ a = 0 , 72 + 15 , 08 - 0 , 13 . 2 = 15 , 54 g a m
Trong X chứa 0,3a mol Al(NO3)3 và 0,2a mol Al2(SO4)3.
Giả sử số mol SO42- lớn hơn số mol Ba2+ → 0 , 6 a > 0 , 1 → a > 0 , 167
Vậy kết tủa chứa BaSO4 0,1 mol.
→ m A l ( O H ) 3 = 4 n A l 3 + - n O H - = 4 . 0 , 7 a - 0 , 26 = 2 , 8 a - 0 , 26 → 233 . 0 , 6 a + 78 ( 2 , 8 a - 0 , 26 ) = 15 , 54 → a = 0 , 1


Vì bài cho tạo khí SO2 nên dd H2SO4 ở đây phải là đặc.
\(n_{SO_2}=\dfrac{4,48}{22,4}=0,2\)
\(2Al+6H_2SO_4\text{ (đặc)}\xrightarrow[]{t^\circ}Al_2\left(SO_4\right)_3+3SO_2+6H_2O\)
\(\dfrac{1}{15}\) ← \(0,2\)
\(\Rightarrow m_{Al_2\left(SO_4\right)_3}=\dfrac{1}{15}\cdot342=22,8\left(g\right)\)