hoà tan hoàn toàn 6,5 kim loại kẽm zn vào dung dịch axit clohidric HCL 10%(vừa đủ) tính thể tích hidro thoát ra(đktc)
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a. \(n_{Zn}=\dfrac{6.5}{65}=0,1\left(mol\right)\)
PTHH : Zn + 2HCl -> ZnCl2 + H2
0,1 0,2 0,1
b. \(V_{H_2}=0,1.22,4=2,24\left(l\right)\)
c. \(m_{HCl}=0,2.36,5=7,3\left(g\right)\)
\(n_{Zn}=\dfrac{6,5}{65}=0,1mol\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,1 0,2 0,1
\(V_{H_2}=0,1\cdot22,4=2,24l\)
\(m_{HCl}=0,2\cdot36,5=7,3g\)

a) Lập công thức hóa học của muối kẽm clorua: Z n C l 2
b) Khối lượng muối Z n C l 2 = 6,5 + 7,3 – 0,2 = 13,6 (gam)

a) Pt: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
b) nFe = \(\dfrac{11,2}{56}=0,2mol\)
Theo pt: nH2 = nFe = 0,2 mol
=> VH2 = 0,2.22,4 = 4,48lit
c) Theo pt: nHCl = 2nFe = 0,4 mol
=> mHCl = 0,4.36,5 = 14,6 g
=> C% = \(\dfrac{14,6}{73}.100\%=20\%\)

a) Pt:
b) nFe = \(\dfrac{11,2}{56}=0,2mol\)
Theo pt: nH2 = nFe = 0,2 mol
=> VH2 = 0,2.22,4 = 4,48lit
c) Theo pt: nHCl = 2nFe = 0,4 mol
=> mHCl = 0,4.36,5 = 14,6 g
=> \(C\%=\dfrac{14,6}{73}.100\%=20\%\)

\(n_{Zn}=\dfrac{6,5}{65}=0,1mol\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,1 0,1 0,1 ( mol )
\(V_{H_2}=0,1.22,4=2,24l\)
\(m_{ZnCl_2}=0,1.136=13,6g\)
\(n_{Zn}=\dfrac{6,5}{65}=0,1mol\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,1 0,2 0,1 0.1
\(V_{H_2}=0,1\cdot22,4=2,24l\)
\(m_{ZnCl_2}=0,1\cdot135=13,5g\)

\(a.Zn+2HCl\rightarrow ZnCl_2+H_2\\ n_{Zn}=n_{ZnCl_2}=n_{H_2}=0,25\left(mol\right)\\ \Rightarrow m_{Zn}=0,25.65=16,25\left(g\right)\\ m_{ZnCl_2}=0,25.136=34\left(g\right)\\ b.FeO+H_2-^{t^o}\rightarrow Fe+H_2O\\ Tacó:n_{Fe}=n_{H_2}=0,25\left(mol\right)\\ \Rightarrow m_{Fe}=0,25.56=14\left(g\right)\)
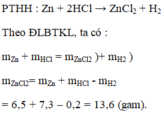

nZn = 6.5/65 = 0.1 (mol)
Zn + 2HCl =>ZnCl2 + H2
0.1..............................0.1
VH2 = 0.1 * 22.4 = 2.24 (l)