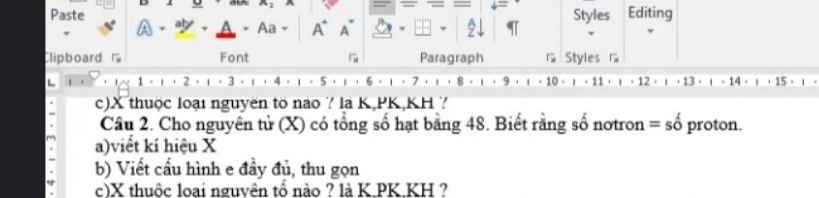
Cho S (Z =16) ; Ca (Z =20). a. Viết cấu hình electron của các nguyên tử trên. c. Viết cấu hình electron của các ion tương ứng S2- ; Ca2+.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Al : 1s22s22p63s23p1 ( kim loại vì lớp e ngoài cùng có 3e)
S : 1s22s22p63s23p4 ( phi kim vì lớp e ngoài cùng có 6e )
O : 1s22s22p4 ( phi kim vì lớp e ngoài cùng có 6e )
Fe : 1s22s22p63s23p63d64s2 ( kim loại vì lớp e ngoài cùng có 2e )
Cu : 1s22s22p63s23p63d104s1 ( kim loại vì lớp e ngoài cùng có 1e )
Zn : 1s22s22p63s23p63d104s2 ( kim loại vì lớp e ngoài cùng có 2e )
Cl : 1s22s22p63s23p5 ( kim loại vì lớp e ngoài cùng có 7e )
K : 1s22s22p63s23p64s1 ( kim loại vì lớp e ngoài cùng có 1e )
Br : 1s22s22p63s23p63d104s24p5 (kim loại vì lớp e ngoài cùng có 7e )
Ne : 1s22s22p6 ( khí hiếm vì lớp e ngoài cùng có 8e )
- Nguyên tố s : K ( e cuối cùng điền vào phân lớp s )
- Nguyên tố p : O, Ne, S, Cl, Br, Al ( e cuối cùng điền vào phân lớp p )
- Nguyên tố d : Fe, Cu, Zn ( e cuối cùng điền vào phân lớp d )


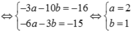



- Nguyên tử S nhận thêm 2 electron để thành ion S2-
⟹ Thêm 2 electron vào cấu hình electron của nguyên tử S ta sẽ được cấu hình electron của ion S2-
⟹ Cấu hình electron của ion S2-: 1s22s22p63s23p6.
- Nguyên tử Ca nhường đi 2 electron để trở thành ion Ca2+.
⟹ Bớt 2 electron từ cấu hình electron của nguyên tử Ca ta sẽ được cấu hình electron của ion Ca2+.
⟹ Cấu hình electron của ion Ca2+: 1s22s22p63s23p6.
a: S: \(1s^22s^22p^63s^23p^4\)
Ca: \(1s^22s^22p^63s^23p^64s^2\)
b: \(S^{2-}:1s^22s^22p^63s^23p^6\)
Ca2+: \(1s^22s^22p^63s^23p^6\)