Cho 336 ml khí nitơ ở đktc. Tính:
a) Số phân tử nitơ và số nguyên tử nitơ.
b) Khối lượng nitơ.
c) Thể tích nitơ ở đkc và đk thường.
d) Nếu trộn 336 ml khí nitơ ở đktc với 1 gam khí hiđro được hỗn hợp khí A. Tính tỉ khối của hỗn hợp khí
A đối với khí metan (CH4) và đối với không khí.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

5. Cr2O3
4. 10%
3. Sinh ra khí không màu dễ hoá nâu ngoài không khí
2. 9/136 là ra
1. [(56:1000):22,4] x 32 là ra

a)
$n_{N_2} = \dfrac{5,6}{28} = 0,2(mol)$
b)
Số phân tử khí $N_2$ : $N = 0,2.6.10^{23} = 1,2.10^{23}$ phân tử
c)
$V_{N_2} = 0,2.22,4 = 4,48(lít)$

N 2 (k) + 3 H 2 (k) ↔ 2 N H 3 (k)
Số mol khí ban đầu :
2 7 0
Số mol khí đã phản ứng :
x 3x
Số mol khí lúc cần bằng :
2 - x 7 - 3x 2x
Tổng số mol khí lúc cân bằng : (2 - x) + (7 - 3x) + 2x = 9 - 2x
Theo đề bài : 9 - 2x = 8,2 ⇔ x = 0,4
1. Phần trăm sô mol nitơ đã phản ứng: 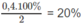
2. Thể tích (đktc) khí amoniac được tạo thành: 2.0,4.22,4 = 17,9 (lít).

Đáp án A
![]()
Nhận thấy đáp án đều là các amin no đơn chức mạch hở nên ta tính ngay được số mol amin bằng việc áp dụng công thức tính nhanh:
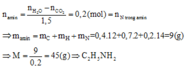

\(a.V_{NH_3}=0,8.22,4=17,92\left(l\right)\\ b.n_{N_2}=\dfrac{140}{28}=5\left(mol\right)\\ V_{N_2}=112\left(l\right)\\ n_{O_2}=\dfrac{96}{32}=3\left(mol\right)\\ V_{O_2}=22,4.3=67,2\left(l\right)\)
\(c.n_{hh}=0,5+0,2=0,7\left(mol\right)\\ V_{hh}=0,7.22,4=15,68\left(l\right)\\ d.m_{NH_3}=4,25\left(g\right)\\ n_{CO}=\dfrac{28}{22,4}=1,25\left(mol\right)\\ m_{CO}=1,25.28=35\left(g\right)\\ m_{hh}=4,25+35=39,25\left(g\right)\)
a. Thể tích của 0,8 mol khí NH3 (đktc)
=>VNH3=0,8.22,4=17,92l
b. Thể tích ở đktc của 140 g khí Nitơ ; 96g khí Oxi
nN2=140\14.2=5 mol
nO2=96\32=3 mol
=>Vhh=(5+3).22,4=179,2l
c. Thể tích của hỗn hợp khí gồm 0,5 mol Cl2 và 0,2 mol N2 ở điều kiện tiêu chuẩn.
=>Vhh=(0,5+0,2).22,4=15,68l
d. Khối lượng của hỗn hợp 0,25 mol khí NH3 , 28lit khí CO.
n CO=28\22,4=1,25 mol
=>mhh=0,25.17+1,25.28=39,25g
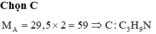
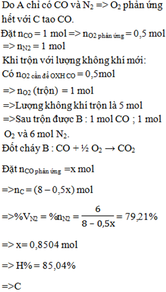
a. Số mol khí N2 là: \(\dfrac{0,336}{22,4}=0,015\left(mol\right)\)
Số phân tử N2 là: 0,015 x 6.1023 = 9.1021 (phân tử)
Số nguyên tử N là: 2x9.1021=18.1023 (nguyên tử)
b. Khối lượng N2 là: 0,015x28 = 0,42 (g)
c. Thể tích khí N2 ở đk thường là: \(\dfrac{0,336}{24}=0,014\left(mol\right)\)
Thể tích khí N2 ở đk chuẩn là: \(\dfrac{0,336}{24,7}=0,0136\left(mol\right)\)
d. Số mol H2 là: \(\dfrac{1}{2}=0,5\left(mol\right)\)
Khối lượng mol của hỗn hợp khí A: \(M_A=\dfrac{0,5x2+0,015x28}{0,5+0,015}=\dfrac{1,42}{0,515}\simeq2,757\)
+ Tỷ khối của hỗn hợp khí A với Mêtan:
\(M_A=\dfrac{1,42}{0,515x16}\simeq0,17\)
+ Tỷ khối của hỗn hợp khí A với không khí:
\(M_A=\dfrac{1,42}{0,515x29}\simeq0,095\)