cho bột sắt tan hoàn toàn trong 300g dd H2SO4 đặc nóng ,nồng độ 78,4% thu đc 16,8l khí SO2(đktc) và dd A . tính nồng độ % cuả chất tan trong dd A
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Giả sử có 1 mol Fe tác dụng
PTHH: 2Fe + 6H2SO4 --> Fe2(SO4)3 + 3SO2 + 6H2O
1---->3----------->0,5------->1,5
Giả sử khối lượng dd H2SO4 78,4% là m (gam)
=> \(m_{H_2SO_4\left(bđ\right)}=\dfrac{m.78,4}{100}=0,784m\left(g\right)\)
=> \(m_{H_2SO_4\left(dư\right)}=0,784m-3.98=0,784m-294\left(g\right)\)
mdd sau pư = 1.56 + m - 1,5.64 = m - 40 (g)
Do C% của Fe2(SO4)3 và H2SO4 dư là bằng nhau
=> \(m_{Fe_2\left(SO_4\right)_3}=m_{H_2SO_4\left(dư\right)}\)
=> 400.0,5 = 0,784m - 294
=> m = \(\dfrac{30875}{49}\left(g\right)\)
mdd sau pư = \(\dfrac{28915}{49}\left(g\right)\)
=> \(C\%_{Fe_2\left(SO_4\right)_3}=C\%_{H_2SO_4\left(dư\right)}=\dfrac{200}{\dfrac{28915}{49}}.100\%=33,89\%\)

\(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\\ n_{SO_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
PTHH:
2Al + 3H2SO4 ---> Al2(SO4)3 + 3H2
0,2<-----0,3<-----------0,1-------------0,3
Cu + 2H2SO4 ---> CuSO4 + SO2 + 2H2O
0,1<---------------------------------0,1
\(\rightarrow\left\{{}\begin{matrix}m_{Al}=0,2.27=5,4\left(g\right)\\m_{Cu}=0,1.64=6,4\left(g\right)\end{matrix}\right.\\ \rightarrow\left\{{}\begin{matrix}\%m_{Al}=\dfrac{5,4}{11,8}.100\%=45,76\%\\\%m_{Cu}=100\%-45,76\%=54,24\%\end{matrix}\right.\)
\(m_{ddA}=\dfrac{0,3.98}{20\%}+5,4-0,3.2=151,8\left(g\right)\\ C\%_{Al_2\left(SO_4\right)_3}=\dfrac{0,1.342}{151,8}.100\%=22,53\%\)

B1:
2NaOH+H2SO4\(\rightarrow\)Na2SO4+2H2O
nNaOH=\(\frac{4}{40}=0.1\)mol
=>nH2SO4=\(\frac{1}{2}\)nNaOH=0.05 mol
=>CM=\(\frac{n_{H2SO42}}{V}\)=\(\frac{0.05}{200}\)=2,5.10-4 (M)
B2:
Mg+\(\frac{1}{2}\)O2\(\underrightarrow{t^0}\)MgO (1)
MgO+2HCl\(\rightarrow\)MgCl2+H2O (2)
nMg(1)=\(\frac{0,36}{24}=0,015mol\)
=>nMgO(1)=0,015=nMgO(2)
nHCl(2)=2nMgO(2)=0,03mol
=>CM(HCl)=\(\frac{n_{HCl}}{V}=\frac{0,03}{100}=3.10^{-4}M\)

\(n_{Mg}=\dfrac{4,8}{24}=0,2\left(mol\right)\)
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
0,2-->0,4----->0,2------->0,2
a
\(V_{H_2}=0,2.22,4=4,48\left(l\right)\)
b
\(CM_{MgCl_2}=\dfrac{0,2}{0,2}=1M\)
c
\(MgCl_2+2NaOH\rightarrow Mg\left(OH\right)_2+2NaCl\)
0,2------>0,4
\(V_{dd.NaOH}=\dfrac{0,4}{2}=0,2\left(l\right)\)
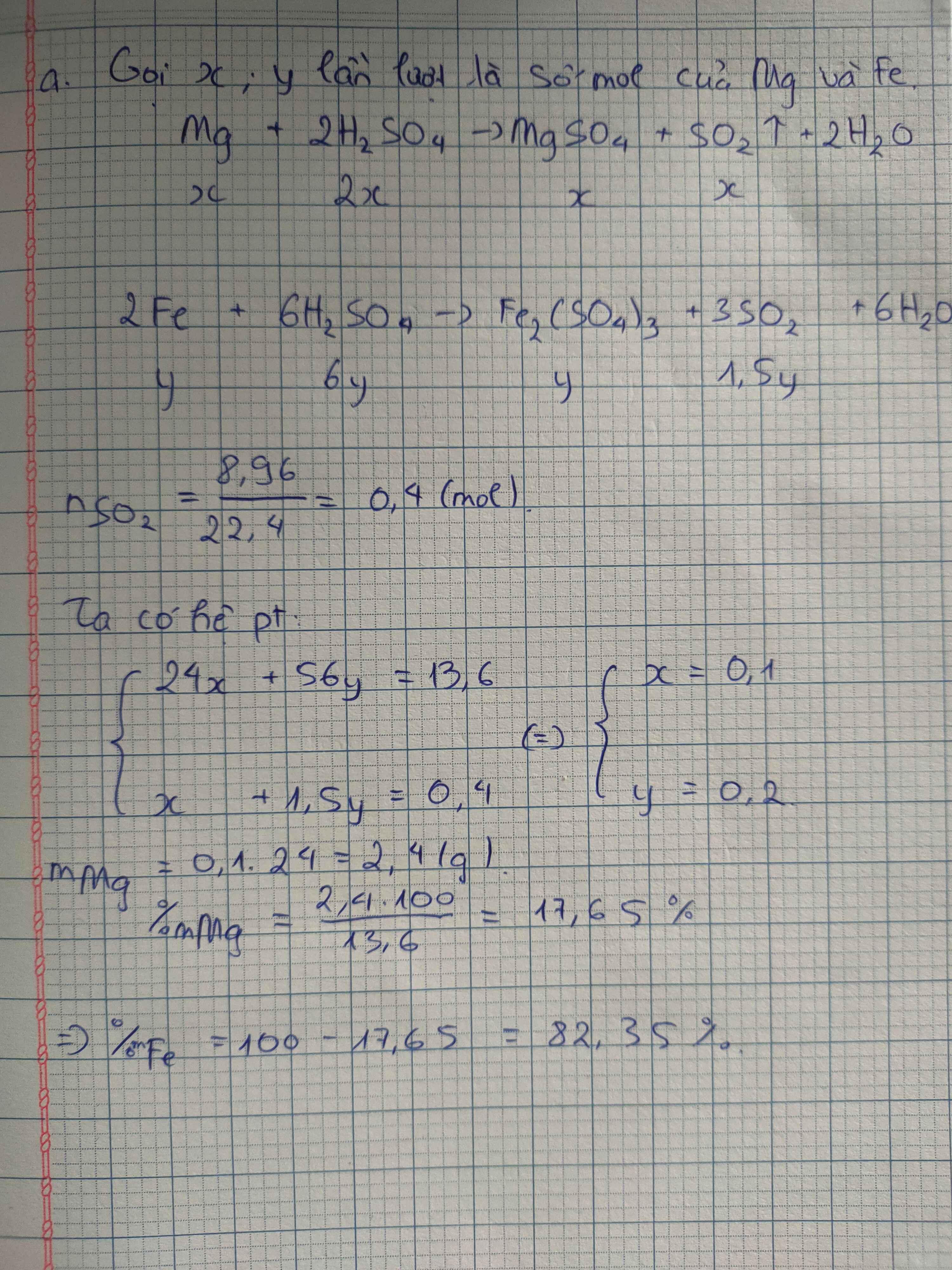

Ta có: \(n_{SO_2}=\dfrac{16,8}{22,4}=0,75\left(mol\right)\)
\(m_{H_2SO_4}=300.78,4\%=235,2\left(g\right)\Rightarrow n_{H_2SO_4}=\dfrac{235,2}{98}=2,4\left(mol\right)\)
PT: \(2Fe+6H_2SO_{4\left(đ\right)}\underrightarrow{t^o}Fe_2\left(SO_4\right)_3+3SO_2+6H_2O\)
____0,5____1,5________0,25______0,75 (mol)
\(\Rightarrow n_{H_2SO_4\left(dư\right)}=2,4-1,5=0,9\left(mol\right)\)
Ta có: m dd sau pư = mFe + m dd H2SO4 - mSO2
= 0,5.56 + 300 - 0,75.64 = 280 (g)
\(\Rightarrow\left\{{}\begin{matrix}C\%_{H_2SO_4\left(dư\right)}=\dfrac{0,9.98}{280}.100\%=31,5\%\\C\%_{Fe_2\left(SO_4\right)_3}=\dfrac{0,25.400}{280}.100\%\approx35,7\%\end{matrix}\right.\)
Bạn tham khảo nhé!