Đốt cháy hết 6.4g rượu etylic trong oxi a, tính Vo2 cần dùng,Vkk? Đktc b, tính V02 tạo thành đktx
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(a.C_2H_5OH+3O_2-^{t^o}\rightarrow2CO_2+3H_2O\\ n_{C_2H_5OH}=0,3\left(mol\right)\\ n_{CO_2}=2n_{C_2H_5OH}=0,6\left(mol\right)\\ \Rightarrow V_{CO_2}=0,6.22,4=13,44\left(l\right)\\ b.n_{O_2}=3n_{C_2H_5OH}=0,6\left(mol\right)\\ MàV_{O_2}=\dfrac{1}{5}V_{kk}\\ \Rightarrow V_{kk}=V_{O_2}.5=0,6.22,4.5=67,2\left(l\right)\\ c.n_{NaOH}=0,9\left(mol\right)\\ Tacó:\dfrac{n_{NaOH}}{n_{CO_2}}=\dfrac{0,9}{0,6}=1,5\\ \Rightarrow Tạora2muốiNaHCO_3vàNa_2CO_3\\ Đặt:n_{NaHCO_3}=x\left(mol\right);n_{Na_2CO_3}=y\left(mol\right)\\ \Rightarrow\left\{{}\begin{matrix}x+y=0,6\left(BTnguyento\left(C\right)\right)\\x+2y=0,9\left(BTnguyento\left(Na\right)\right)\end{matrix}\right.\\ \Rightarrow\left\{{}\begin{matrix}x=0,3\\y=0,3\end{matrix}\right.\\ \Rightarrow m_{muối}=0,3.84+0,3.106=57\left(g\right)\)

nCu = 6,4/64 = 0,1 (mol)
PTHH: 2Cu + O2 -> (t°) 2CuO
Mol: 0,1 ---> 0,05 ---> 0,1
mCuO = 0,1 . 80 = 8 (g)
Vkk = 0,05 . 5 . 22,4 = 5,6 (l)

a) $C_2H_5OH + 3O_2 \xrightarrow{t^o} 2CO_2 + 3H_2O$
b) $n_{C_2H_5OH} = \dfrac{4,6}{46} = 0,1(mol)$
$n_{O_2} = 3n_{C_2H_5OH} = 0,3(mol)$
$V_{O_2} = 0,3.22,4 = 6,72(lít)$
c)
Theo PTHH :
$n_{CO_2} = 2n_{C_2H_5OH} = 0,2(mol) \Rightarrow V_{CO_2} = 0,2.22,4 = 4,48(lít)$
$n_{H_2O} = 3n_{C_2H_5OH} = 0,3(mol) \Rightarrow m_{H_2O} = 0,3.18 = 5,4(gam)$

nFe = 46,4/56 = 29/35 (mol)
PTHH: 4Fe + 3O2 -> (t°) 2Fe2O3
Mol: 29/35 ---> 87/140 ---> 29/70
mFe2O3 = 29/70 . 160 = 464/7 (g)
Vkk = 87/140 . 5 . 22,4 = 69,6 (l)
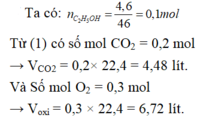


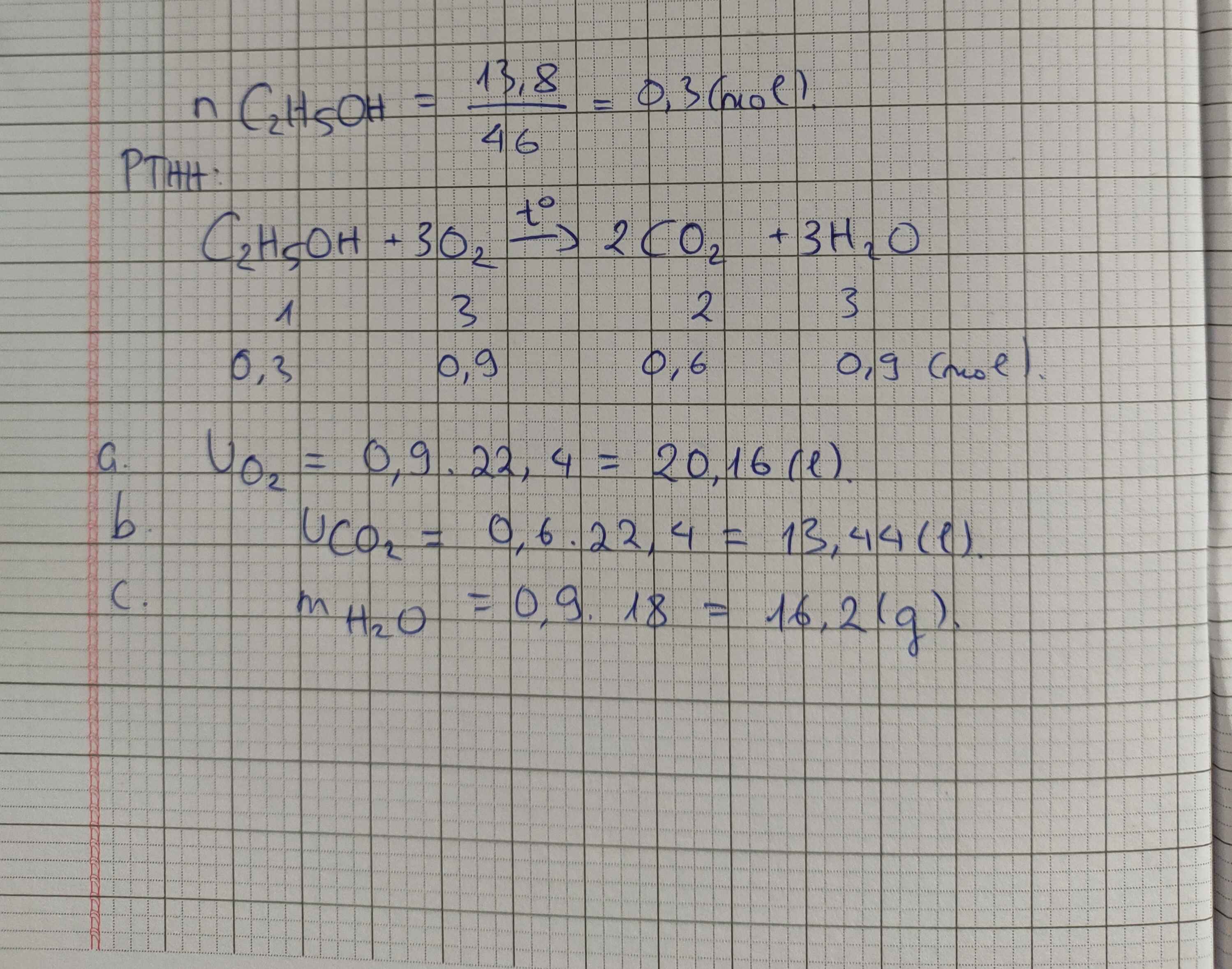
PTHH: \(C_2H_5OH+3O_2\xrightarrow[]{t^o}2CO_2+3H_2O\)
Ta có: \(n_{C_2H_5OH}=\dfrac{6,4}{46}=\dfrac{16}{115}\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}n_{O_2}=\dfrac{48}{115}\left(mol\right)\\n_{CO_2}=\dfrac{32}{112}\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}V_{O_2}=\dfrac{48}{115}\cdot22,4\approx9,35\left(l\right)\\V_{CO_2}=\dfrac{32}{112}\cdot22,4\approx6,23\left(l\right)\end{matrix}\right.\)