cho 10 gam hỗn hợp X gồm Fe và FeO tác dụng với axit clohidic tạo ra muối và 2,24 (l) khí hidro (đktc)
a) viết PTHH
b) tính khối lượng từng chất trong hỗn hợp X
c) tính % khối lượng từng chất trong X?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{H2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
a) Pt : \(Fe+2HCl\rightarrow FeCl_2+H_2|\)
1 2 1 1
0,2 0,4 0,2
b) \(n_{Fe}=\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
\(m_{Fe}=0,2.56=11,2\left(g\right)\)
\(m_{Cu}=16-11,2=4,8\left(g\right)\)
c) \(n_{HCl}=\dfrac{0,2.2}{1}=0,4\left(mol\right)\)
⇒ \(m_{HCl}=0,4.36,5=14,6\left(g\right)\)
Chúc bạn học tốt

\(n_{H_2}=\dfrac{3,36}{22,4}=0,15mol\\ a)ZnO+H_2SO_4\rightarrow ZnSO_4+H_2O\\ Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
0,15 0,15 0,15 0,15
\(b)m_{Fe}=0,15.56=8,4g\\ m_{ZnO}=16,5-8,4=8,1g\\ c)n_{ZnO}=\dfrac{8,1}{81}=0,1mol\\ ZnO+H_2SO_4\rightarrow ZnSO_4+H_2O\)
0,1 0,1 0,1 0,1
\(V_{ddH_2SO_4}=\dfrac{0,15+0,1}{2}=0,125M\\ d)Fe+CuSO_4\rightarrow FeSO_4+Cu\)
0,15 0,15 0,15 0,15
\(m_{rắn}=m_{ZnO}+m_{Cu}=8,1+0,15.64=17,7g\)

Phương trình hóa học :
Fe + 2HCl → FeCl 2 + H 2
FeO + 2HCl → FeCl 2 + H 2 O
FeCO 3 + 2HCl → FeCl 2 + H 2 O + CO 2
Tính % khối lượng: Gọi số mol Fe, FeO, FeCO 3 trong hỗn hợp là x, y, z => x + y + z = 0,25
Theo phương trình hóa học : Số mol H 2 , CO 2 là x, z
![]()
Mặt khác : 56x + 72y + 116z = 21,6
Giải ra ta có:
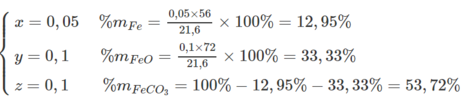

nH2 = 2.24/22.4 = 0.1 (mol)
Na + H2O => NaOH + 1/2 H2
0.2....................0.2..........0.1
mNa = 0.2 * 23 = 4.6 (g)
mNa2O = 17 - 4.6 = 12.4 (g)
nNa2O = 12.4/62 = 0.2 (mol)
Na2O + H2O => 2NaOH
0.2........................0.4
nNaOH = 0.2 + 0.4 = 0.6 (mol)
mNaOH = 0.6 * 40 = 24 (g)
nCuO = 24/80 = 0.3 (mol)
CuO + H2 -t0-> Cu + H2O
1...........1
0.3.........0.1
LTL : 0.3/1 > 0.1/1
=> CuO dư
nCu = nH2 = 0.1 (mol)
mCu = 0.1 * 64 = 6.4 (g)

Gọi số mol Mg, Fe, Al là a, b, c
=> 24a + 56b + 27c = 23,8
PTHH: Mg + 2HCl --> MgCl2 + H2
a------------------------->a
Fe + 2HCl --> FeCl2 + H2
b------------------------->b
2Al + 6HCl --> 2AlCl3 + 3H2
c------------------------->1,5c
=> a + b + 1,5c = \(\dfrac{17,92}{22,4}=0,8\left(mol\right)\)
PTHH: Mg + Cl2 --to--> MgCl2
a-->a
2Fe + 3Cl2 --to--> 2FeCl3
b--->1,5b
2Al + 3Cl2 --to--> 2AlCl3
c--->1,5c
=> \(a+1,5b+1,5c=\dfrac{20,16}{22,4}=0,9\left(mol\right)\)
=> a = 0,3; b = 0,2; c = 0,2
=> \(\left\{{}\begin{matrix}m_{Mg}=0,3.24=7,2\left(g\right)\\m_{Fe}=0,2.56=11,2\left(g\right)\\m_{Al}=0,2.27=5,4\left(g\right)\end{matrix}\right.\)

Gọi \(\left\{{}\begin{matrix}n_{Zn}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\\n_{Al}=c\left(mol\right)\end{matrix}\right.\) => 65a + 56b + 27c = 10,65 (1)
PTHH: Zn + 2HCl --> ZnCl2 + H2
Fe + 2HCl --> FeCl2 + H2
2Al + 6HCl --> 2AlCl3 + 3H2
=> \(n_{H_2}=a+b+1,5c=\dfrac{5,04}{22,4}=0,225\left(mol\right)\) (2)
PTHH: Zn + Cl2 --to--> ZnCl2
2Fe + 3Cl2 --to--> 2FeCl3
2Al + 3Cl2 --to--> 2AlCl3
=> \(n_{Cl_2}=a+1,5b+1,5c=\dfrac{5,6}{22,4}=0,25\left(mol\right)\) (3)
(1)(2)(3) => \(\left\{{}\begin{matrix}a=0,1\left(mol\right)\\b=0,05\left(mol\right)\\c=0,05\left(mol\right)\end{matrix}\right.\) => \(\left\{{}\begin{matrix}m_{Zn}=0,1.65=6,5\left(g\right)\\m_{Fe}=0,05.56=2,8\left(g\right)\\m_{Al}=0,05.27=1,35\left(g\right)\end{matrix}\right.\)
a) \(\left\{{}\begin{matrix}\%m_{Zn}=\dfrac{6,5}{10,65}.100\%=61,033\%\\\%m_{Fe}=\dfrac{2,8}{10,65}.100\%=26,291\%\\\%m_{Al}=\dfrac{1,35}{10,65}.100\%=12,676\%\end{matrix}\right.\)
b) nHCl = 2a + 2b + 3c = 0,45 (mol)
=> mHCl = 0,45.36,5 = 16,425 (g)
=> \(a\%=C\%=\dfrac{16,425}{200}.100\%=8,2125\%\)
c) mdd sau pư = 10,65 + 200 - 0,225.2 = 210,2 (g)
=> \(\left\{{}\begin{matrix}C\%_{ZnCl_2}=\dfrac{0,1.136}{210,2}.100\%=6,47\%\\C\%_{FeCl_2}=\dfrac{0,05.127}{210,2}.100\%=3,02\%\\C\%_{AlCl_3}=\dfrac{0,05.133,5}{210,2}.100\%=3,176\%\end{matrix}\right.\)

n C2H5OH =a (mol) ; n CH3COOH = b(mol)
=> 46a + 60b = 27,2(1)
$2C_2H_5ONa + 2Na \to 2C_2H_5ONa + H_2$
$2CH_3COOH + 2Na \to 2CH_3COONa + H_2$
Theo PTHH :
n H2 = 0,5a + 0,5b = 5,6/22,4 = 0,25(2)
Từ (1)(2) suy ra a = 0,2 ; b = 0,3
Suy ra:
m C2H5OH = 0,2.46 = 9,2(gam)
m CH3COOH = 0,3.60 = 18(gam)

a) Gọi số mol Mg, Al là a, b (mol)
=> 24a + 27b = 1,98 (1)
PTHH: Mg + 2HCl --> MgCl2 + H2
a--->2a-------->a---->a
2Al + 6HCl --> 2AlCl3 + 3H2
b---->3b------->b----->1,5b
=> \(n_{H_2}=a+1,5b=\dfrac{2,352}{22,4}=0,105\left(mol\right)\) (2)
(1)(2) => a = 0,015 (mol); b = 0,06 (mol)
\(\left\{{}\begin{matrix}\%m_{Mg}=\dfrac{0,015.24}{1,98}.100\%=18,18\%\\\%m_{Al}=\dfrac{0,06.27}{1,98}.100\%=81,82\%\end{matrix}\right.\)
b)
\(\left\{{}\begin{matrix}m_{MgCl_2}=0,015.95=1,425\left(g\right)\\m_{AlCl_3}=0,06.133,5=8,01\left(g\right)\end{matrix}\right.\)
\(\left\{{}\begin{matrix}C_{M\left(MgCl_2\right)}=\dfrac{0,015}{0,16}=0,09375M\\C_{M\left(AlCl_3\right)}=\dfrac{0,06}{0,16}=0,375M\\C_{M\left(HCl.dư\right)}=\dfrac{0,16.1,5-0,015.20,06.2}{0,16}=0,5625M\end{matrix}\right.\)