Cho Natri phản ứng hoàn toàn cới H2O thu được NaOH và 11.2(l)khí H2 (dktc)
a, Viết và cân bằng phương trình phản ứng
b, Tính khối lượng Na phản ứng
c,Tính khối lượn NaOH tạo thành
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nSO2 = 12,8 : 64=0,2 (mol)
pthh : S+ O2 -t->SO2
0,2<--0,2<------0,2(mol)
=> mS= 0,2.32=6,4 (g)
=> VO2= 0,2.22,4=4,48 (l)
ta có
VO2 = 1/5 Vkk <=> Vkk = VO2 : 1/5 = 4,48:1/5 = 22.4 (l)
S + O2 to→to→ SO2
nS=12,832=0,4(mol)
a) Theo PT: nSO2=nS=0,4(mol)
⇒VSO2=0,4×22,4=8,96(l)
b) Theo PT: nO2=nS=0,4(mol)
⇒VO2=0,4×22,4=8,96(l)
⇒VKK=5VO2=5×8,96=44,8(l)

\(n_{Fe}=\dfrac{m}{M}=\dfrac{28}{56}=0,5\left(mol\right)\\ PTHH:Fe+2HCl->FeCl_2+H_2\)
ti le 1 : 2 : 1 : 1
n(mol) 0,5-->1--------->0,5------>0,5
\(m_{FeCl_2}=n\cdot M=0,5\cdot\left(56+35,5\cdot2\right)=63,5\left(g\right)\\ V_{H_2\left(dktc\right)}=n\cdot22,4=0,5\cdot22,4=11,2\left(l\right)\)

nNa=4,6/23=0,2(mol)
a) PTHH: 2 Na + 2 H2O -> 2 NaOH + H2
b) Ta có: nNaOH=nNa=0,2(mol)
=>mNaOH=0,2.40=8(g)
nH2= 1/2 . nNa=1/2. 0,2=0,1(mol)
=>V=V(H2,đktc)=0,1.22,4=2,24(l)
Số mol của natri
nNa = \(\dfrac{m_{Na}}{M_{Na}}=\dfrac{4,6}{23}=0,2\left(mol\right)\)
a) Pt : 2Na + 2H2O → 2NaOH + H2\(|\)
2 2 2 1
0,2 0, 0,1
Số mol của khí hidro
nH2 = \(\dfrac{0,2.1}{2}=0,1\left(mol\right)\)
Thể tích của khí hidro
VH2 = nH2 . 22,4
= 0,1. 22,4
= 2,24 (l)
Số mol của natri hidroxit
nNaOH = \(\dfrac{0,1.2}{1}=0,2\left(mol\right)\)
Khối lượng của natri hidroxit
mNaOH = nNaOH . MNaOH
= 0,2 . 40
= 8 (g)
Chúc bạn học tốt

\(n_{Na}=\dfrac{4,6}{23}=0,2mol\)
\(2Na+2H_2O\rightarrow2NaOH+H_2\)
0,2 0,2 0,2 0,1
\(V_{H_2}=0,1\cdot22,4=2,24l\)
\(m_{NaOH}=0,2\cdot40=8g\)
\(m_{ddNaOH}=4,6+0,2\cdot18-0,1\cdot2=8g\)
\(\Rightarrow C\%=\dfrac{m_{NaOH}}{m_{ddNaOH}}\cdot100\%=\dfrac{8}{8}\cdot100\%=100\%???\)
Sửa đề: Tính nồng độ mol của dung dịch NaOH???
\(C_{M_{NaOH}}=\dfrac{0,2}{0,3}=\dfrac{2}{3}M\)

nFe=0,2(mol)
a) PTHH: Fe2O3 + 3 H2 -to-> 2 Fe + 3 H2O
0,1_____________0,3____0,2(mol)
b) mFe2O3=160.0,1=16(g)
c) V(H2,đktc)=0,3.22,4=6,72(l)

a.
BTKL ta có mX = mY => nX . MX = nY . mY
MX / My = nY / mY =0.75
Đặt nX = 1 mol => nY = 0,75 mol => nH2 phản ứng = 1 – 0,75 = 0,25mol
* TH hidrocacbon là anken: n anken = n H2 = 0,25 mol => n H2 trong X = 0,75 => M = (6,75 – 0,75 . 2)/0,25 = 21 (loại) * TH là ankin: => n akin = 0,25/2 = 0,125 => n H2 trong X = 0,875 mol => M = (6,75 – 0,875 . 2)/0,125 = 40 =>C3H4
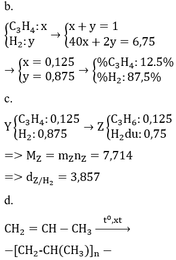


a, \(FeO+H_2\underrightarrow{t^o}Fe+H_2O\)
b, \(n_{FeO}=\dfrac{7,2}{72}=0,1\left(mol\right)\)
\(n_{Fe}=n_{FeO}=0,1\left(mol\right)\Rightarrow m_{Fe}=0,1.56=5,6\left(g\right)\)
c, \(n_{H_2}=n_{FeO}=0,1\left(mol\right)\Rightarrow V_{H_2}=0,1.22,4=2,24\left(l\right)\)

\(2Na+2H_2O\rightarrow2NaOH+H_2\)
\(\dfrac{2}{2}\) = \(\dfrac{2}{2}\) ( mol )
2 2 2 2 ( mol )
( Cả 2 chất đều không dư )
\(m_{H_2}=1.2=2g\)
\(m_{NaOH}=2.40=80g\)
\(2Na+2H_2O\rightarrow2NaOH+H_2\)
2 2 1 ( mol )
\(m_{H_2}=1.2=2g\)
\(m_{NaOH}=2.40=80g\)
a) 2Na + 2H2O -------> 2NaOH + H2
b)
nH2 = 11,2 : 22,4 = 0,5 (mol)
Ta có phương trình sau : 2Na + 2H2O -------> 2NaOH + H2
Theo phương trình : ( 2 ) ( 2 ) ( 2 ) ( 1 ) (mol)
Theo đ.b : ( 1 ) ( 1 ) ( 1 ) (0,5) (mol)
=> mNa = 1.23 = 23 (g)
c) mNaOH = 1.(23 + 16 + 1) = 40 (g)