Có 78,40g hỗn hợp X gồm CuO và 1 kim loại sắt oxit được chia làm 2 phần bằng nhau Phần 1 khử hoàn toàn bằng khí CO dư ở nhiệt độ cao rồi hòa tan hết sản phẩm bằng dung dịch H2SO4 loãng dư thu được 12,80g chất không tan Phần 2 hòa tan trong dung dịch HCl thấy vừa hết 43,80 g HCl Biết các phản ứng xảy ra hoàn toàn
a) Viết phương trình phản ứng tính % khối lượng mỗi chất trong hỗn hợp ban đầu
b) Cho biết tên của sắt oxit

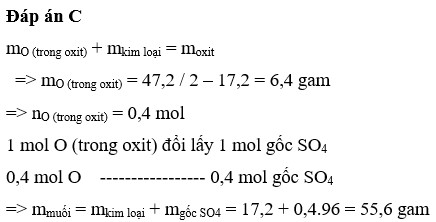





\(\text{a) Khối lượng phần 1 = Khối lượng phần 2 = 78.4/2=39.2}\)
Đặt công thức của oxit sắt là \(Fe_xO_y\)
Phần 1: \(CuO+CO\underrightarrow{t^0}Cu+CO_2\)
\(Fe_xO_y+yCO\underrightarrow{t^0}xFe+yCO_2\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
\(\Rightarrow m_{Cu}=12.8\Rightarrow n_{Cu}=n_{CuO}=0.2\Rightarrow m_{CuO\left(\text{1 phần}\right)}=0.2\times80=16\left(g\right)\)
\(\Rightarrow\%^mCuO=\dfrac{16}{39.2}\times100\approx40.81\%\Rightarrow\%^mFe_xO_y=51.9\%\)
b)
\(\text{Đặt số mol của Fe_xO_y là a( mol)}\)
\(CuO+2HCl\rightarrow CuCl_2+H_2\)
0.2 0.4
\(Fe_xO_y+2yHCl\rightarrow FeCl_{\dfrac{2y}{x}}+yH_2O\)
a 2ay
\(\Sigma^nHCl=\dfrac{43.8}{36.5}=1.2\left(mol\right)\)
=> 2ay+0.4=1.2=>ay=0.4 (1)
\(m_{Fe_xO_y\left(\text{1 phần}\right)}=39.2-16=23.2\Rightarrow n_{Fe_xO_y}=a=\dfrac{23.2}{56x+16y}\left(mol\right)\)
=>(56x+16y)a=23.2=>56ax+16ay=23.2 (2)
Từ (1) (2) => 56ax+16*0.4=23.2=>56ax=16.8=> ax=0.3 (3)
\(\text{Từ (1) (3)}\Rightarrow\dfrac{ax}{ay}=\dfrac{0.3}{0.4}\Rightarrow\dfrac{x}{y}=\dfrac{3}{4}\)
Công thức oxit sắt là \(Fe_3O_4\)