PHOTPHO cháy mạnh trong khí oxi sinh ra chất gì?
A.SO2
B.P2O5
C.SO3
PH3
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a) \(n_P=\dfrac{6,2}{31}=0,2\left(mol\right)\)
PTHH: 4P + 5O2 --to--> 2P2O5
0,2-->0,25----->0,1
=> V = 0,25.22,4 = 5,6 (l)
b) \(m_{P_2O_5}=0,1.142=14,2\left(g\right)\)

Câu 1 :
\(n_P=\dfrac{12,4}{31}=0,4\left(mol\right)\)
Pt : \(4P+5O_2\underrightarrow{t^o}2P_2O_5|\)
4 5 2
0,4 0,2
\(n_{P2O5}=\dfrac{0,4.2}{4}=0,2\left(mol\right)\)
⇒ \(m_{P2O5}=0,2.142=28,4\left(g\right)\)
Chúc bạn học tốt
Câu 2 :
\(n_P=\dfrac{12,4}{31}=0,4\left(mol\right)\)
\(n_{O2\left(dktc\right)}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
Pt : \(4P+5O_2\underrightarrow{t^o}2P_2O_5|\)
4 5 2
0,4 0,25 0,1
Lập tỉ số só sánh : \(\dfrac{0,4}{4}>\dfrac{0,25}{5}\)
⇒ P dư , O2 phản ứng hết
⇒ Tính toán dựa vào số mol của O2
\(n_{P2O5}=\dfrac{0,25.2}{5}=0,1\left(mol\right)\)
⇒ \(m_{P2O5}=0,1.142=14,2\left(g\right)\)
\(n_{P\left(dư\right)}=0,4-\left(\dfrac{0,25.4}{5}\right)=0,2\left(mol\right)\)
⇒ \(m_{P\left(dư\right)}=0,2.31=6,2\left(g\right)\)
\(m_{rắn}=14,2+6,2=20,4\left(g\right)\)
Chúc bạn học tốt

a, \(4P+5O_2\underrightarrow{t^o}2P_2O_5\)
b, \(n_P=\dfrac{6,2}{31}=0,2\left(mol\right)\)
\(n_{O_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,2}{4}< \dfrac{0,4}{5}\), ta được O2 dư.
Theo PT: \(n_{O_2\left(pư\right)}=\dfrac{5}{4}n_P=0,25\left(mol\right)\Rightarrow n_{O_2\left(dư\right)}=0,4-0,25=0,15\left(mol\right)\)
\(\Rightarrow m_{O_2\left(dư\right)}=0,15.32=4,8\left(g\right)\)
c, Theo PT: \(n_{P_2O_5}=\dfrac{1}{2}n_P=0,1\left(mol\right)\Rightarrow m_{P_2O_5}=0,1.142=14,2\left(g\right)\)
d, \(m_{P_2O_5}=14,2.80\%=11,36\left(g\right)\)

a)
\(n_P = \dfrac{62}{31} = 2(mol)\\ 4P + 5O_2 \xrightarrow{t^o} 2P_2O_5\\ n_{O_2} = \dfrac{5}{4}n_P = 2,5(mol)\\ V_{O_2} = 2,5.22,4 = 56(lít)\\ V_{không\ khí} = \dfrac{56}{20\%} = 280(lít)\)
b)
\(n_P = \dfrac{31}{31} = 1(mol) ; n_{O_2} = \dfrac{23}{32} = 0,71875(mol)\\ \dfrac{n_P}{4} = 0,25 > \dfrac{n_{O_2}}{5} = 0,14375 \to P\ dư\\ n_{P\ pư} = \dfrac{4}{5}n_{O_2} = 0,575(mol)\\ m_{P\ dư} = 31 - 0,575.31 = 13,175(gam)\\ n_{P_2O_5} = \dfrac{2}{5}n_{O_2} = 0,2875(mol) \Rightarrow m_{P_2O_5} = 0,2875.142=40,825(gam)\)

\(n_P=\dfrac{12,4}{31}=0,4mol\)
\(n_{O_2}=\dfrac{17}{32}=0,53125mol\)
\(4P+5O_2\rightarrow\left(t^o\right)2P_2O_5\)
\(\dfrac{0,4}{4}\) < \(\dfrac{0,53125}{5}\) ( mol )
0,4 0,5 0,2 ( mol )
\(m_{O_2\left(dư\right)}=\left(0,53125-0,5\right).32=1g\)
\(m_{P_2O_5}=0,2.142=28,4g\)

$a) 4P + 5O_2 \xrightarrow{t^o} 2P_2O_5$
$n_P = \dfrac{6,2}{31} = 0,2(mol) ; n_{O_2} = \dfrac{7,84}{22,4} = 0,35(mol)$
$n_P : 4 = 0,05 < n_{O_2} :5 = 0,07$ nên $O_2$ dư
$n_{O_2\ pư} = \dfrac{5}{4}n_P = 0,25(mol)$
$\Rightarrow m_{O_2\ dư} = (0,35 - 0,25).32 = 3,2(gam)$
c) $n_{P_2O_5} = \dfrac{1}{2}n_P = 0,1(mol)$
$m_{P_2O_5} = 0,1.142 = 14,2(gam)$
\(n_P=\dfrac{6,2}{31}=0,2\left(mol\right)\\ n_{O_2}=\dfrac{7,84}{22,4}=0,35\left(mol\right)\\a, 4P+5O_2\rightarrow\left(t^o\right)2P_2O_5\\ V\text{ì}:\dfrac{0,35}{5}>\dfrac{0,2}{4}\Rightarrow O_2d\text{ư}\\ n_{O_2\left(d\text{ư}\right)}=0,35-\dfrac{5}{4}.0,2=0,1\left(mol\right)\\b, m_{O_2\left(d\text{ư}\right)}=0,1.32=3,2\left(g\right)\\ c,n_{P_2O_5}=\dfrac{n_P}{2}=\dfrac{0,2}{2}=0,1\left(mol\right)\\ m_{r\text{ắn}}=m_{P_2O_5}=142.0,1=14,2\left(g\right)\)
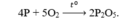
B
\(4P+5O_2\rightarrow\left(t^o\right)2P_2O_5\)
B.P2O5