Cho 30 gam hỗn hợp Ca và CaO tác dụng với nước dư thu được 6.72 lít khí H2 ở đktc. Tính khối lượng mỗi chất có trong hỗn hợp. Làm thế nào để nhận biết được dung dịch sau phản ứng là axit hay bazo.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


nH2 = \(\dfrac{1,68}{22,4}=0,075\) mol
Pt: CaO + H2O --> Ca(OH)2
.....Ca + 2H2O --> Ca(OH)2 + H2
0,075 mol <----------------------0,075 mol
mCa = 0,075 . 40 = 3 (g)
mCaO = mhh - mCa = 8,6 - 3 = 5,6 (g)
Nhúng quỳ tím vào dd sau pứ, nếu quỳ tím chuyển sang màu xanh là bazơ, nếu quỳ tím chuyển sang màu đỏ là axit
nH2=1,68/22,4=0,075(mol)
Ca+2H2O--->Ca(OH)2+H2
0,075________________0,075
CaO+H2O--->Ca(OH)2
mCa=0,075.40=3(g)
=>mCaO=8,6-3=5,6(g)
Cho quỳ tím vào
Quỳ tím hóa đỏ=>axit
Quỳ tím hóa xanh=>dd bazơ

\(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH: Zn + 2HCl -->ZnCl2 + H2
____0,2<----------------------0,2
=> mZn = 0,2.65 = 13 (g)
mCu = mrắn không tan = 19,5 (g)
\(\left\{{}\begin{matrix}\%Zn=\dfrac{13}{13+19,5}.100\%=40\%\\\%Cu=\dfrac{19,5}{13+19,5}.100\%=60\%\end{matrix}\right.\)
`n_(H_2)=4,48/22,4=0,2 (mol)`
Ta có PTHH: `Zn+2HCl --> ZnCl_2 +H_2`
Theo PT: `1`--------------------------------`1`
Theo đề: `0,2`------------------------------`0,2`
`m_(Zn)=0,2.65=13(g)`
Vì `Cu` không phản ứng với `HCl` nên `m_(chất rắn không tan)=m_(Cu)=19,5(gam)`
`%Zn=13/(13+19,5) .100%=40%`
`%Cu=100%-40%=60%`

Ca + 2H2O \(\rightarrow\) Ca(OH)2 + H2 (1)
CaO + H2O \(\rightarrow\) Ca(OH)2 (2)
a) nH2 =V/22,4 = 1,68/22,4 = 0,075(mol)
Theo PT(1) => nCa = nH2 = 0,075(mol)
=> mCa = n .M = 0,075 x 40 =3(g)
=> mCaO = 8,6 - 3 =5,6(g)
b)Cách đơn giản nhất : Đưa mẩu giấy quỳ tím vào dung dịch . Nếu quỳ tím hóa đỏ là axit còn hóa xanh là bazo và tất nhiên sau phản ứng thì dung dịch sau 2 phản ứng trên là bazo bạn nhé!

Giải thích:
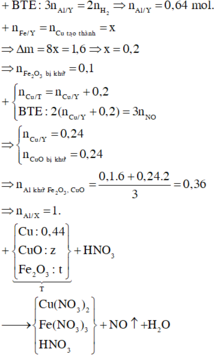
Ở phần 1 khi cho tác dụng với NaOH có sinh ra khí H2 => nhôm dư
Phần 1
nH2 = 0,0525 mol => nAl dư = 0,035 mol
chất rắn không tan tác dụng với HCl => nH2 = 0,045 mol => nFe = 0,045 mol
Phần 2
nH2 = 0,2925 mol
Giả sử phần 2 = k. phần 1
Bảo toàn e ở phần 2 ta có (3 . 0,035 + 2 . 0,045) . k = 2 . 0,2925 => k = 3
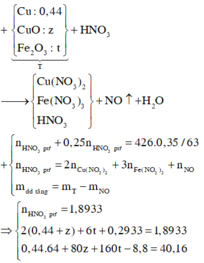
Có mA = mB = 4 khối lượng phần 1
=> tổng lượng H2 ở thí nghiệm 1 = 4 . (0,0525 + 0,045 ) = 0,39
=> nFe3O4 = (4 . 0,045) : 3 = 0,06 mol
=> 3nAl = 2.nFe3O4 + 2nH2 => nAl = 0,3 mol
=> mA = 0,3 . 27 + 0,06 . 232 = 22,02 mol
%Al = 37% và %Fe3O4 = 63%
Đáp án A

Đáp án C
Dựa vào để ra:
Phần 1 chứa 0,03 mol Al dư và rắn không tan là Fe 0,06 mol, do vậy phần 1 chứa 0,03 mol Al2O3.
Khối lượng của phần 1 là 7,23 gam do vậy bằng 1/3 của Y.
Phần 2 gấp 2 lần phần 1 chứa 0,06 mol Al dư, 0,12 mol Fe và 0,06 mol Al2O3.
Khí Z thu được chứa NO 0,12 mol và H2 0,03 mol.
Dung dịch T chứa Fe3+ amol, Fe2+ bmol, NH4+ c mol, Al3+ 0,18 mol, K+ và Cl-.

Cho T tác dụng với AgNO3 dư được 147,82 gam kết tủa gồm AgCl 10c+0,9 (bảo toàn Cl) và Ag b mol(Fe2+).
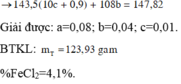
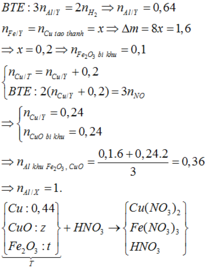
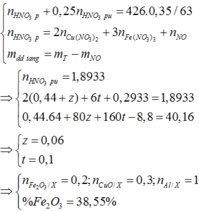
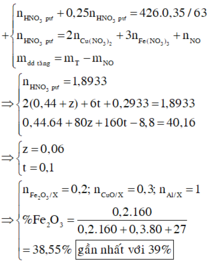
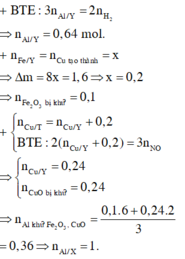
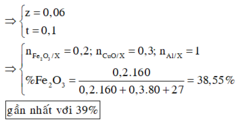

\(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\\ pthh:Ca+2H_2O\rightarrow Ca\left(OH\right)_2+H_2\)
0,3 0,3
\(m_{Ca}=0,3.40=12\left(g\right)\\ m_{CaO}=30-12=18\left(g\right)\)
t cho Qùy tím vào dd
Qùy tím hóa đỏ là axit
Qùy tím hóa xanh là bazo