Cho 13g kẽm tác dụng vs 49g H2SO4 a)Sau p/ư chất nào còn dư,dư bao nhiêu b)khối lg muối tạo thành và thể tích H2 sau p/ư c)dẫn toàn bộ khí H2 qua 16g CuO nung nóng.tính khối lg Cu thu đc
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(a) Zn + H_2SO_4 \to ZnSO_4 + H_2\\ b) n_{Zn} = \dfrac{13}{65} = 0,2 < n_{H_2SO_4} = \dfrac{49}{98} = 0,5 \to H_2SO_4\ dư\\ c) n_{H_2}= n_{Zn} = 0,2(mol)\\ V_{H_2} = 0,2.22,4= 4,48(lít)\\ d) CuO + H_2 \xrightarrow{t^o} Cu + H_2O\\ n_{Cu} = n_{H_2}= 0,2(mol)\\ m_{Cu} = 0,2.64= 12,8(gam)\)
a)PTHH(1): Zn+H2SO4 →ZnSO4+H2
b) theo gt: nZn=1365=0,2(mol);
nH2SO4=4998=0,5(mol)
nZn=1365=0,2(mol);
nH2SO4=4998=0,5(mol)
theo PTHH: nZn=1(mol); nH2SO4=1(mol)nZn=1(mol); nH2SO4=1(mol)
ta có tỉ lệ: 0,21 < 0,51⇒H2SO4dư 0,21 < 0,51⇒H2SO4dư , tính số mol các chất theo Zn
ta có theo PTHH: nH2SO4= nZn=0,2(mol)
⇒ nH2SO4dư=0,5−0,2=0,3(mol)
⇒ mH2SO4dư=0,3⋅98=29,4(g)
Do tỉ lệ phương trình là 1:1:1:1
=> nH2 = nZn = 0,2 mol
=> VH2= n.22,4= 0,2.22,4= 4,48 (l)
c) PTHH(2) : Cuo + H2 Cu + H2O
Theo PTHH (1) và tích chất bắc cầu ta được
=> nH2 = nCu = 0,2 mol
=> mCu = n.M= 0,2.64= 12,8 (g)

a, \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(H_2+CuO\underrightarrow{t^o}Cu+H_2O\)
b, Ta có: \(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
Theo PT: \(n_{ZnCl_2}=n_{H_2}=n_{Zn}=0,2\left(mol\right)\Rightarrow m_{ZnCl_2}=0,2.136=27,2\left(g\right)\)
c, \(n_{CuO}=\dfrac{20}{80}=0,25\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,2}{1}< \dfrac{0,25}{1}\), ta được CuO dư.
Theo PT: \(n_{CuO\left(pư\right)}=n_{H_2}=0,2\left(mol\right)\Rightarrow n_{CuO\left(dư\right)}=0,25-0,2=0,05\left(mol\right)\)
\(\Rightarrow m_{CuO\left(dư\right)}=0,05.80=4\left(g\right)\)

a) Fe + 2HCl ->FeCl2 +H2 (1)
0.2 0.2
H2 + CuO ->Cu + H2O (2)
0.2 0.2
b)n(Fe)=11.2/56= 0.2 mol
m(Cu)=0.2*64=12.8 (g)
(1) :p/ư thế ,FeCl2(sắt II clorua )
(2) :p/ư oxi hóa -khử

a) $Fe + H_2SO_4 \to FeSO_4 + H_2$
b) Ta thấy :
$n_{Fe} = \dfrac{5,6}{56} = 0,1 > n_{H_2SO_4} = \dfrac{1,96}{98} = 0,02$
Do đó Fe dư
$n_{Fe\ pư} = n_{H_2SO_4} = 0,02(mol)$
$m_{Fe\ dư} = 5,6 - 0,02.56 = 4,48(gam)$
c)
$n_{FeSO_4} = n_{H_2SO_4} = 0,02(mol) \Rightarrow m_{FeSO_4} = 0,02.152 = 3,04(gam)$
d)
$n_{H_2} = n_{H_2SO_4} = 0,02(mol)$
$V_{H_2} = 0,02.22,4 = 0,448(lít)$
nFe=5,6/56=0,1(mol)
nH2SO4=1,96/98=0,02(mol)
a) PTHH: Fe + H2SO4 -> FeSO4 + H2
b) Ta có: 0,02/1 < 0,1/1
=> Fe dư, H2SO4 hết => Tính theo nH2SO4.
=> nFe(p.ứ)=nFeSO4=nH2=nH2SO4=0,02(mol)
=>nFe(dư)=0,1 - 0,02=0,08(mol)
c) =>mFe(dư)= 0,08.56=4,48(g)
d) V(H2,đktc)=0,02.22,4=0,448(l)
Chúc em học tốt!

a) \(Mg+2HCl\rightarrow MgCl_2+H_2\)
\(n_{Mg}=\dfrac{2,4}{24}=0,1\left(mol\right)\)
Theo PTHH ta có: \(n_{MgCl_2}=n_{Mg}=0,1\left(mol\right)\)
\(\Rightarrow m_{MgCl_2}=n_{MgCl_2}.M_{MgCl_2}=0,1.95=9,5\left(g\right)\)
b) Theo PTHH ta có: \(n_{H_2}=n_{Mg}=0,1\left(mol\right)\)
\(\Rightarrow V_{H_2}=n_{H_2}.22,4=0,1.22,4=2,24\left(l\right)\)
c) \(2H_2+O_2\rightarrow2H_2O\)
Theo PTHH: \(n_{H_2O}=\dfrac{0,1.2}{2}=0,1\left(mol\right)\)
\(\Rightarrow m_{H_2O}=n_{H_2O}.M_{H_2O}=0,1.18=1,8\left(g\right)\)
a)mMg= 2,4/24=0,1(mol) nMgCl2=0,1.1/1=0,1 (mol) mMgCl2= 0,1.95=9,5(g) b)nH2=0,1.1/1=0,1(mol) v=n.22,4=2,24(lít

\(n_{Zn}=\dfrac{m}{M}=\dfrac{3,25}{65}=0,05\left(mol\right)\)
\(PTHH:Zn+2HCl\rightarrow ZnCl_2+H_2\)
1 2 1 1
0,05 0,1 0,05 0,05
a) \(V_{H_2}=n.24,79=0,05.24,79=1,2395\left(l\right)\)
\(m_{ZnCl_2}=n.M=0,05.\left(65+35,5.2\right)=6,8\left(g\right)\)
b) \(PTHH:CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
Ta cos tỉ lệ: \(\dfrac{0,1}{1}>\dfrac{0,05}{1}\Rightarrow\) CuO dư.
Theo ptr, ta có: \(n_{Cu}=n_{H_2}=0,05mol\\ \Rightarrow m_{Cu}=n.M=0,05.64=3,2\left(g\right).\)
a, PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
Ta có: \(n_{Zn}=\dfrac{3,25}{65}=0,05\left(mol\right)\)
THeo PT: \(n_{ZnCl_2}=n_{H_2}=n_{Zn}=0,05\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,05.24,79=1,2395\left(l\right)\)
\(m_{ZnCl_2}=0,05.136=6,8\left(g\right)\)
b, Ta có: \(n_{CuO}=\dfrac{8}{80}=0,1\left(mol\right)\)
PT: \(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
Xét tỉ lệ: \(\dfrac{0,1}{1}>\dfrac{0,05}{1}\), ta được CuO dư.
Theo PT: \(n_{Cu}=n_{H_2}=0,05\left(mol\right)\Rightarrow m_{Cu}=0,05.64=3,2\left(g\right)\)

a, Ta có:
nZn = 13/65= 0,2(mol)
PTHH: Zn + H2SO4 → ZnSO4 + H2
0,2-----------------------------------0,2
Theo PT : nZnSO4 = 0,2.1/1 = 0,2(mol)
mZnSO4 = 0,2. 161 = 32,2(g)
b, Ta có:
Theo PT : nH2 = 0,2.1/1 = 0,2(mol)
VH2(đktc) = 0,2 . 22,4 = 4,48(l)
CuO+H2-to>Cu+H2O
0,2-----0,2
=>m Cu=0,2.64=12,8g
Cậu ơi cho tớ hỏi ngu tý là cái mà "0,2---------0,2" là ntn vậy ạ :"))?
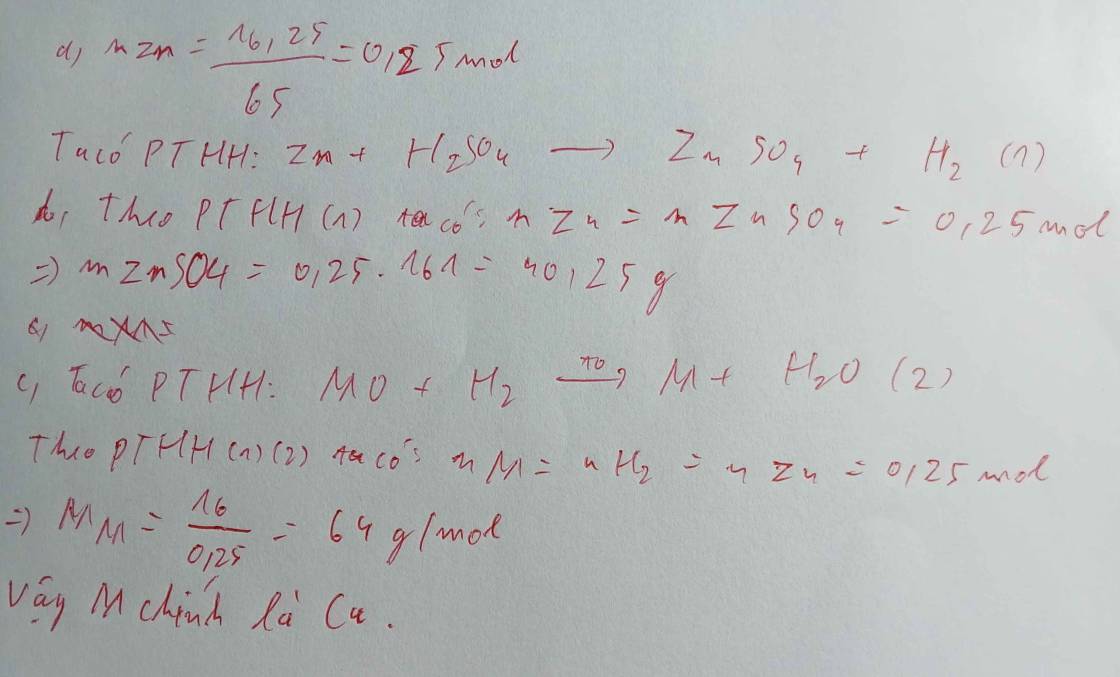
nZn = 13/ 65 = 0,2 (mol)
nH2SO4 = 49/98 = 0 ,5 (mol)
Zn + H2SO4 -- > ZnSO4 +H2
LTL : 0,2/1 < 0,5/1
=> Zn đủ , H2SO4 dư
mH2SO4 dư = ( 0,5 - 0,2 ) . 98 = 29,4 (g)
mmuối = mZnSO4 =0,2 . 161 = 32,2 (g)
VH2 = 0,2 . 22,4 = 4,48 (l)
H2 + CuO -- > Cu + H2O
nCuO = 16/80 = 0,2 (mol)
= > H2 , CuO đều pứ đủ
=> mCu = 0,2.64 = 12,8(g)