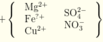Hòa tan 12,9 gam hỗn hợp 2 kim loại đều có hóa trị II vào dung dịch H2SO4 loãng dư , sau khi phản ứng kết thúc hoàn toàn , còn lại 6,4 gam kim loại không tan , lọc hết kim loại không tan ra thấy khối lượng tăng 6,3 g . Đem đốt cháy phần kim loại không tan trong không khí đến khối lượng không đổi thu được 8 gam một oxit duy nhất . Xác định 2 kim loại trên
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án C
Gọi số mol của Cu và F e 3 O 4 lần lượt là x, y mol
Nhận thấy kim loại còn dư là Cu (0,06 mol) => dung dịch chứa C u S O 4 : x - 0 , 6 và F e S O 4 : 3 y m o l
Bảo toàn nhóm
![]()
![]()
Ta có hệ
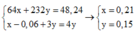
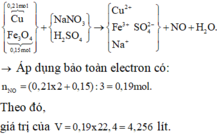
Vì N a N O 3 dư, H 2 S O 4 dư nên khí NO tính theo Cu và F e 3 O 4
Bảo toàn electron cho toàn bộ quá trình
![]()
![]()
=> V = 4,256 lit

Chọn đáp án B
nCu = 12/64 = 0,1875 và nFe2O3 = 19,2/160 = 0,12 ⇒ nFe3+ tạo ra = 0,12.2 = 0,24 < 2nCu
Vậy ![]()

nHCl = 0,35 . 1 = 0,35 (mol)
\(X+2HCl\rightarrow XCl_2+H_2\)
0,175 0,35 0,175 0,175 (mol)
nHCl (pứ 2 ) = 0,2 . 2 = 0,4 (mol)
\(X+2HCl\rightarrow XCl_2+H_2\)
0,2 0,4
\(nX=0,175+0,2=0,375\left(mol\right)\)
=> \(MX=\dfrac{11,7}{0,375}=\) 31,2 .-. k ra là s

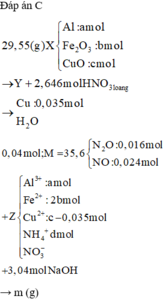
Đáp án C
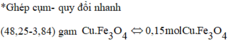
→ 48,24 gam hỗn hợp ban đầu gồm 0,15 mol Fe 3 O 4 và (0,15 + 3,84 : 64 = 0,21 mol) Cu.
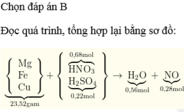
Sơ đồ gộp quá trình:
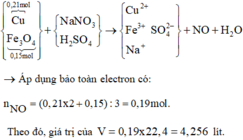

Đọc quá trình, tổng hợp lại bằng sơ đồ:

Bảo toàn nguyên tố H có nH2O = 0,56 mol → ghép cụm có nNO = 0,28 mol.
Bảo toàn N có nNO3- trong X = 0,4 mol và bảo toàn S có nSO42- = 0,22 mol.
Dung dịch X có thể tích 200 mL + 44 mL = 244 mL. Công thức: CM = n ÷ V
⇒ [SO42-] = 0,22 ÷ 0,244 = 0,902M và [NO3-] = 0,4 ÷ 0,244 = 1,640M.
Đáp án B