Cho 11,2 gam sắt tác dung với dung dịch loãng có chứa 49gam axit sunfuaric H2SO4. Tính thể tích khí hiđro thu được (Ở đktc)
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


nH2SO4= 0,125(mol)
nFe=0,2(mol)
PTHH: Fe + H2SO4 -> FeSO4 + H2
Vì: 0,125/1 < 0,2/1
=> Fe dư, H2SO4 hết, tính theo nH2SO4
-> nH2=nH2SO4=0,125(mol)
=>V(H2,đktc)=0,125.22,4=2,8(l)

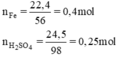
Phương trình hóa học của phản ứng:

So sánh tỉ lệ 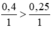 ⇒ Fe dư
⇒ Fe dư
Theo PT nFe (pư) = nH2SO4 = 0,25 mol ⇒ nFe dư = 0,4 – 0,25 = 0,15 mol
mFe dư = 0,15. 56 = 8,4g.
Do khối lượng Fe dư nên tính thể tích khí H2 theo số mol H2SO4.
nH2 = nH2SO4 = 0,25 mol
Vkhí = 0,25 . 22,4 = 5,6l.

\(n_{Fe}=\dfrac{22,4}{56}=0,4\left(mol\right);n_{H_2SO_4}=\dfrac{24,5}{98}=0,25\left(mol\right)\\ PTHH:Fe+H_2SO_4\rightarrow FeSO_4+H_2\\ Vì:\dfrac{0,4}{1}>\dfrac{0,25}{1}\Rightarrow Fe.dư\\ n_{H_2}=n_{Fe\left(p.ứ\right)}=n_{H_2SO_4}=0,25\left(mol\right)\\ a,V_{H_2\left(đktc\right)}=0,25.22,4=5,6\left(l\right)\\ b,n_{Fe\left(dư\right)}=0,4-0,25=0,15\left(g\right)\\ m_{Fe\left(dư\right)}=0,14.56=8,4\left(g\right)\)

\(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\\
n_{H_2SO_4}=\dfrac{24,5}{98}=0,25\left(mol\right)\\
pthh:Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
\(LTL:\dfrac{0,2}{1}< \dfrac{0,25}{1}\)
=> H2SO4 dư
\(n_{H_2}=n_{H_2SO_4\left(p\text{ư}\right)}=n_{Fe}=0,2\left(mol\right)\\
V_{H_2}=0,2.22,4=4,48l\\
m_{H_2SO_4\left(d\right)}=\left(0,25-0,2\right).98=4,9g\)

a) nFe=0,4(mol); nH2SO4=0,5(mol)
PTHH: Fe + H2SO4 -> FeSO4 + H2
Ta có: 0,4/1 < 0,5/1
=> Fe hết, H2SO4 dư. tính theo nFe.
=> nH2= nH2SO4(p.ứ)=nFe=0,4(mol)
=>nH2SO4(dư)=0,5-0,4=0,1(mol)
=>H2SO4(dư)=0,1.98=9,8(g)
b) V(H2,dktc)=0,4.22,4=8,96(l)

a, \(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
\(n_{H_2SO_4}=\dfrac{29,4}{98}=0,3\left(mol\right)\)
PT: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
Xét tỉ lệ: \(\dfrac{0,2}{1}< \dfrac{0,3}{1}\), ta được H2SO4 dư.
Theo PT: \(n_{H_2SO_4\left(pư\right)}=n_{Fe}=0,2\left(mol\right)\Rightarrow n_{H_2SO_4\left(dư\right)}=0,3-0,2=0,1\left(mol\right)\)
\(\Rightarrow m_{Fe}=0,1.98=9,8\left(g\right)\)
b, \(n_{H_2}=n_{Fe}=0,2\left(mol\right)\Rightarrow n_{H_2}=0,2.22,4=4,48\left(l\right)\)
c, \(n_{CuO}=\dfrac{24}{80}=0,3\left(mol\right)\)
PT: \(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
Xét tỉ lệ: \(\dfrac{0,3}{1}>\dfrac{0,2}{1}\), ta được CuO dư.
Theo PT: \(n_{Cu}=n_{H_2}=0,2\left(mol\right)\Rightarrow m_{Cu}=0,2.64=12,8\left(g\right)\)

bn hỏi bài này rồi mà :) ? và vẫn không check lại cau c)
bài trc của bn có ng giải rồi đấy :v
\(n_{Fe}=\dfrac{44}{56}=0,8\left(mol\right)\\ pthh:Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
0,8 0,8
\(V_{H_2}=0,8.22,4=17,92L\\
pthh:CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
0,8 0,8
\(m_{CuO}=0,8.64=51,2g\)

a)\(n_{Fe}=\dfrac{44,8}{56}=0,8mol\)
\(n_{H_2SO_4}=\dfrac{49}{98}=0,5mol\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
0,8 0,5 0,5 0,5
b)\(V_{H_2}=0,5\cdot22,4=11,2l\)
c)\(CuO+H_2\rightarrow Cu+H_2O\)
0,5 0,5 0,5
\(m_{CuO}=0,5\cdot80=40g\)

`Fe + H_2 SO_4 -> FeSO_4 + H_2↑`
`0,2` `0,2` `(mol)`
`n_[Fe] = [ 11,2 ] / 56 = 0,2 (mol)`
`n_[H_2 SO_4] = 49 / 98 = 0,5 (mol)`
Ta có: `[ 0,2 ] / 1 < [ 0,5 ] / 1`
`=> Fe` hết, `H_2 SO_4` dư
`-> V_[H_2] = 0,2 . 22,4 = 4,48 (l)`