Cần vừa đủ m1 gam O2 để đốt cháy hoàn toàn m2 gam hỗn hợp X gồm Cu và Al, thu được 28,4 gam hỗn hợp 2 oxit của Cu và Al có tỉ lệ mol lần lượt là 1:2.
a. Viết PTHH.
b. Tính m1 và m2
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
Kết thúc phản ứng còn dư lại m1 (g) chất rắn Z
=> Z là Cu, dd Y gồm FeCl2 và CuCl2.
Fe3O4 + 8HCl → 2FeCl3 + FeCl2
0,01<---- 0,08 ------> 0,01
=> n C u = 0,02
2FeCl3 + Cu → 2FeCl2 + CuCl2
0,02 -----> 0,01 --> 0,02
=> n C u dư = 0,01 => m1 = 6,4g
dd Y tác dụng với A g N O 3
Ag+ + Cl- → AgCl
0,08 <--- 0,08 ----> 0,08
Fe2+ + Ag+ → Fe3+ + Ag
0,03 → 0,03
=> m2 = 0,03.108 + 0,08.143,5 = 14,72g

X là các đồng phân của (C17H35COO)(C17H33COO)(C17H31COO)C3H5 hay đều có công thức phân tử C57H104O6
→ nX = nCO2/57 = 0,285/57 = 0,005 (mol)
→ nH2O = 104/2. nX = 104/2. 0,005 = 0,26 (mol)
BTNT "O": 6nX + 2nO2 = 2nCO2 + nH2O
→ 6.0,005 + 2nO2 = 2.0,285 + 0,26
→ nO2 = a = 0,4 (mol)
Muối thu được gồm: C17H35COONa: 0,005 (mol); C17H33COONa: 0,005 (mol); C17H31COONa: 0,005 (mol)
→ m1 = 0,005. (306 + 304 + 302) = 4,56 (g)
Đáp án cần chọn là: C

Chọn C.
Chất X có CTPT là C57H104O6 Þ nX = 0,005 mol ; m = 4,42 (g) và n O 2 = 80 n X = 0 , 4 m o l
Khi cho X tác dụng với NaOH thì: → B T K L m 1 = 4 , 56 ( g )


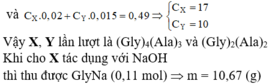


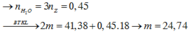

ta có : 80x+102.2x=28,4
=>x=0,1 mol
2Cu+O2-to>2CuO
0,1----------------0,1
4Al+3O2-to>2Al2O3
0,1----------------0,2
=>m1=0,1.64=6,4g
=>m2=0,1.27=2,7g
Gọi số mol của CuO và Al2O3 lần lượt là x và y
Ta có:
\(2Cu+O_2\underrightarrow{t^o}2CuO\)
x 0,5x x ( mol)
\(4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
y 0,75 0,5 y (mol)
theo tỉ lệ số mol của Cu và Al ta có:
\(\dfrac{nCu}{nAl}=\dfrac{1}{2}\)
= > \(2nCu=nAl\)
=> \(2x-y=0\)
Ta có hệ pt theo đề bài:
\(\left\{{}\begin{matrix}64x+27y=28,4\\2x-y=0\end{matrix}\right.\)
giải hệ pt x và y lẽ đề ..