Hòa tan hoàn toàn 20 gam hỗn hợp X gồm Fe và FeO vào m gam dung dịch H2SO4 9,8% (loãng), (dư 10% so với lượng đã lấy) thì thu được 2,24 lít khí (đktc)
a) Tính % theo khối lượng của FeO và giá trị m
b) Cho toàn bộ lượng X trên tác dụng với H2SO4 đặc, nóng, dư thu được V lít khí SO2 (sản phẩm khử duy nhất ở đktc). Tính V
c) Lượng khí SO2 này có thể làm mất màu tối đa bao nhiêu ml dung dịch Br2 1M
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án : D
+) A + HCl : 2 khí là H2 và CO2 => nH2 = nCO2 = 0,06 mol
=> nFe = nFeCO3 = 0,06 mol
+) A + HNO3 -> 1 muối là Fe(NO3)3 có n = 0,4 mol
Hỗn hợp khí gồm CO2 và khí hóa nâu ngoài không khí là NO
=> nCO2 + nNO = 0,2 mol => nNO = 0,14 mol
Bảo toàn e : 3nFe + nFe2+(oxit,hidroxit) + nFeCO3 = 3nNO
=> nFe2+(oxit,hidroxit) = 0,18 mol
Bảo toàn Fe : nFe2+(oxit,hidroxit) + nFe3+(oxit,hidroxit) + nFe + nFeCO3 = 0,4 mol
=> nFe3+(oxit,hidroxit) = 0,1 mol
+) A + HCl -> muối gồm FeCl2 và FeCl3
=> nFeCl3 = nFe3+(oxit,hidroxit) = 0,1 mol
Và nFeCl2 = nFe2+(oxit,hidroxit) + nFe + nFeCO3 = 0,3 mol
=> m = 54,35g

\(n_{Fe}=a\left(mol\right),n_{FeO}=b\left(mol\right)\)
\(m_X=56a+72b=12.8\left(g\right)\)
\(n_{H_2}=n_{Fe}=\dfrac{2.24}{22.4}=0.1\left(mol\right)\)
\(\Rightarrow a=0.1\)
\(b=\dfrac{12.8-56\cdot0.1}{72}=0.1\left(mol\right)\)
\(BTe:\)
\(3n_{Fe}+n_{FeO}=2n_{SO_2}\)
\(\Rightarrow n_{SO_2}=\dfrac{3\cdot0.1+0.1}{2}=0.2\left(mol\right)\)
\(V_{SO_2}=0.2\cdot22.4=4.48\left(l\right)\)
\(\)

Đáp án B
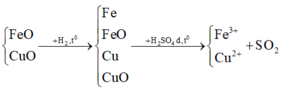
Xét toàn bộ quá trình:
Số oxi hóa của sắt tăng từ +2 lên +3
Số oxi hóa của đồng không thay đổi
Số oxi hóa của hidro tăng từ 0 lên +1
Số oxi hóa của lưu huỳnh giảm từ +6 xuống +4
Áp dụng định luật bảo toàn mol electron cho toàn bộ quá trình ta được:
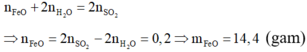

Ta có:
n H2 = 0,05 ( mol )
1.PTHH
Fe + H2SO4 ====> FeSO4 + H2
FeO + H2SO4 ====> FeSO4 + H2O
theo pthh: n Fe = n H2 = 0,05 ( mol )
=> m Fe = 2,8 ( g )
=> m FeO = 7,2 ( g ) => n FeO = 0,1 ( mol )
2.
theo pthh: n H2SO4 = 0,05 + 0,1 = 0,15
=> m H2SO4 = 14,7 ( g )
=> m dd H2SO4 9,8% = 150 ( g )

\(n_{H2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
Pt : \(Fe+H_2SO_4\rightarrow FeSO_4+H_2|\)
1 1 1 1
0,05 0,05 0,05 0,05
\(FeO+H_2SO_4\rightarrow FeSO_4+H_2O|\)
1 1 1 1
0,1 0,1 0,1
1) \(n_{Fe}=\dfrac{0,05.1}{1}=0,05\left(mol\right)\)
\(m_{Fe}=0,05.56=2,8\left(g\right)\)
\(m_{FeO}=10-2,8=7,2\left(g\right)\)
2) Có : \(m_{FeO}=7,2\left(g\right)\)
\(n_{FeO}=\dfrac{7,2}{72}=0,1\left(mol\right)\)
\(n_{H2SO4\left(tổng\right)}=0,05+0,1=0,15\left(mol\right)\)
\(m_{H2SO4}=0,15.98=14,7\left(g\right)\)
\(m_{ddH2SO4}=\dfrac{14,7.100}{9,8}=150\left(g\right)\)
3) \(n_{FeSO4\left(tổng\right)}=0,05+0,1=0,15\left(mol\right)\)
⇒ \(m_{FeSO4}=0,15.152=22,8\left(g\right)\)
\(m_{ddspu}=10+150-\left(0,05.2\right)=159,9\left(g\right)\)
\(C_{FeSO4}=\dfrac{22,8.100}{159,9}=14,26\)0/0
Chúc bạn học tốt



