Cho 13,44 lít hỗn hợp khí CH4 và C2H4 đi qua bình đựng dd brom, thì dùng hết 200ml dd brom và thấy thoát ra 6,72 lít một chất khí (ở đktc) a. Tính thành phần phần trăm theo thể tích mỗi khí trong hỗn hợp ban đầu. b. Tính nồng độ mol của dd brom đã dùng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a)
Khí thoát ra: CH4
\(\%V_{CH_4} = \dfrac{6,72}{16,8}.100\% = 40\%\\ \%V_{C_2H_4} = 100\% - 40\% = 60\%\)
b)
\(n_{C_2H_4} = \dfrac{16,8-6,72}{22,4} = 0,45(mol)\\ C_2H_4 + Br_2 \to C_2H_4Br_2\\ n_{Br_2} = n_{C_2H_4} = 0,45(mol)\\ \Rightarrow C_{M_{Br_2}} = \dfrac{0,45}{2} = 0,225M\\ c) n_{C_2H_4Br_2} = n_{C_2H_4} = 0,45(mol)\\ \Rightarrow n_{C_2H_4Br_2} = 0,45.188 = 84,6(gam)\)
Bài 4:
a) n(hỗn hợp khí)= 16,8/22,4=0,75(mol)
- Khí thoát ra là khí CH4.
=> nCH4=6,72/22,4=0,3(mol)
nC2H4=0,75-0,3=0,45(mol)
- Số mol tỉ lệ thuận với thể tích.
%V(CH4)=%nCH4= (0,3/0,75).100=40%
=> %V(C2H4)=100% - 40%=60%
b) PTHH: C2H4 + Br2 -> C2H4Br2
nC2H4Br2= nBr2=nC2H4=0,45(mol)
=>VddBr2= 0,45/2=0,225(l)
c) mC2H4Br2=0,45. 188= 84,6(g)

a, \(C_2H_2+2Br_2\rightarrow C_2H_2Br_4\)
b, - Khí thoát ra là CH4 ⇒ VCH4 = 6,72 (l)
\(\Rightarrow\left\{{}\begin{matrix}\%V_{CH_4}=\dfrac{6,72}{13,44}.100\%=50\%\\\%V_{C_2H_2}=50\%\end{matrix}\right.\)
a. PTHH: \(C_2H_2+2Br_2\rightarrow C_2H_2Br_4\)
a. Vì CH4 không phản ứng với dd Br2 nên
\(V_{CH_4}=6,72\left(l\right)\)
\(\%V_{CH_4}=\dfrac{6,72}{13,44}x100\%=50\%\)
\(\%V_{C_2H_2}=100\%-50\%=50\%\)

\(n_{Br_2}=\dfrac{4}{160}=0,025\left(mol\right);n_{hh}=\dfrac{2,8}{22,4}=0,125\left(mol\right)\)
PTHH: \(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
0,025<-0,125
\(\Rightarrow\left\{{}\begin{matrix}\%V_{C_2H_4}=\dfrac{0,025}{0,125}.100\%=20\%\\\%V_{CH_4}=100\%-20\%=80\%\end{matrix}\right.\)

1. \(n_{Br_2}=0,4.0,5=0,2\left(mol\right)\)
PT: \(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
Theo PT: \(n_{C_2H_4}=n_{Br_2}=0,2\left(mol\right)\Rightarrow V_{C_2H_4}=0,2.22,4=4,48\left(l\right)\)
2. \(n_{C_2H_4Br_2}=\dfrac{9,4}{188}=0,05\left(mol\right)\)
PT: \(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
Theo PT: \(n_{C_2H_4}=n_{C_2H_4Br_2}=0,05\left(mol\right)\)
\(\Rightarrow\%V_{C_2H_4}=\dfrac{0,05.22,4}{1,4}.100\%=80\%\)
\(\Rightarrow\%V_{CH_4}=100-80=20\%\)

ta có :
nBr2=\(\dfrac{16}{160}=0,1mol\)
C2H4+Br2->C2H4Br2
0,1------0,1
=>VC2H4=0,1.22,4=2,24l
=>VCH4=3,36l->n CH4=0,15 mol
->%VC2H4=\(\dfrac{2,24}{5,6}.100\)=40%
=>%VCH4=60%
c)
CH4+2O2-to>CO2+2H2O
0,15---------------0,15
C2H4+3O2--to>2CO2+2H2O
0,1--------------------0,2
=>m CaCO3=0,35.100=35g

sai kìa bn
cái phần số mol của brom phải là 0,03375 chứ bn
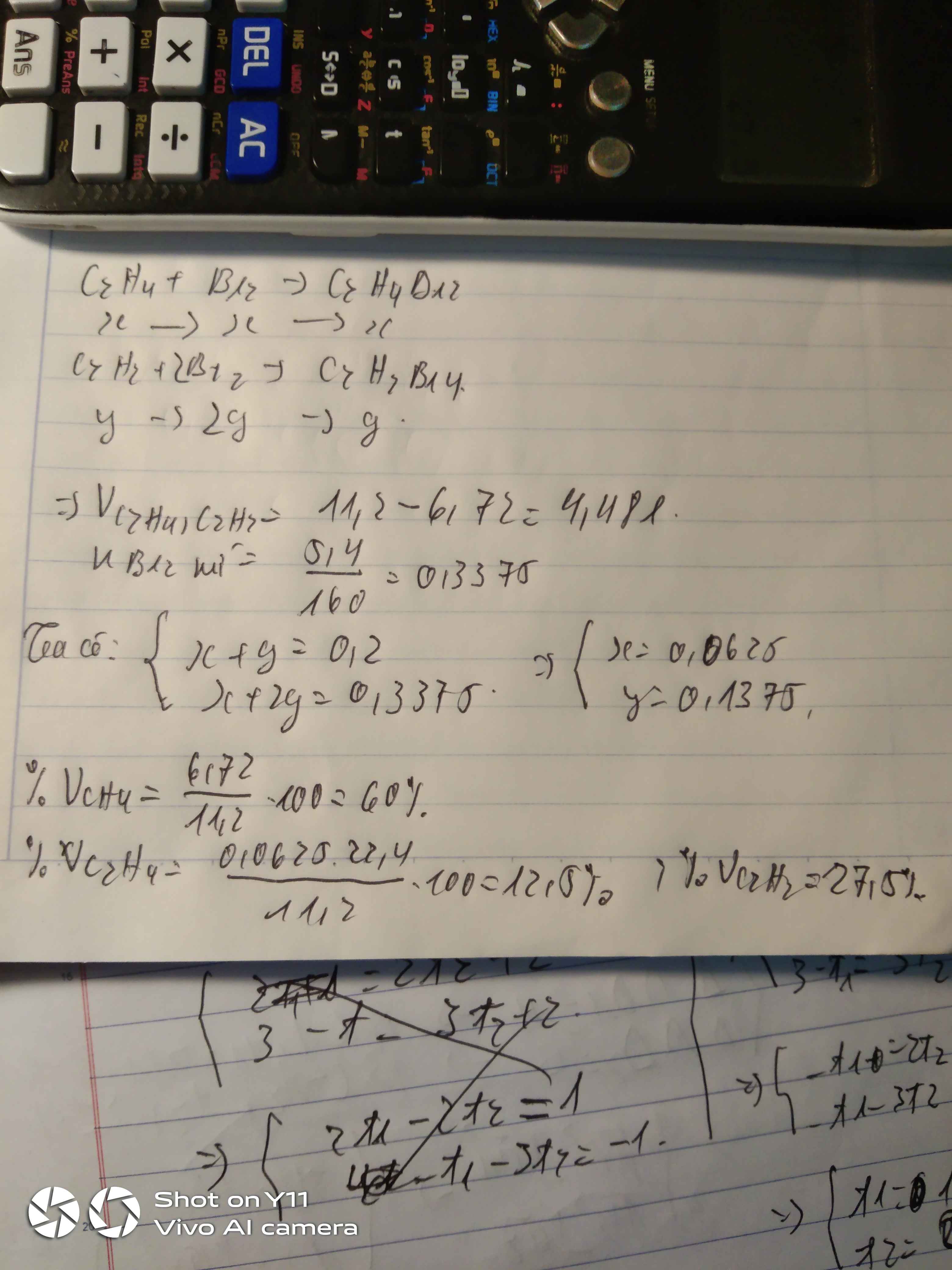
a) Khí thoát ra là CH4
\(\%V_{CH_4} = \dfrac{6,72}{13,44}.100\% = 50\%\\ \%V_{C_2H_4} = 100\% -50\% = 50\%\\ b)\\ C_2H_4 + Br_2 \to C_2H_4Br_2\\ n_{Br_2} = n_{C_2H_4}= \dfrac{13,44.50\%}{22,4} = 0,3(mol)\\ C_{M_{Br_2}} = \dfrac{0,3}{0,2} = 1,5M\)