Hòa tan hoàn toàn 4,48 gam bột sắt vào lượng dư axit HNO3 thu được V lít khí (đktc) hỗn hợp khí gồm N2O và N2, không có sản phẩm khử khác. Tỉ khối của A so với H2 là 18,45. Viết ptpư, tính V
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Chọn đáp án A
Vì nNO2=nN2 ta tưởng tượng như nhấc 1 O trong NO2 rồi lắp vào N2 như vậy X sẽ chỉ có hai khí là NO và N2O.Khi đó

![]()
=1,1(mol)
![]()

Đáp án B
- Khi cho hỗn hợp tác dụng với H2SO4 loãng dư chỉ có Mg phản ứng sinh ra khí H2 => nMg=nH2=0,15 mol
- Khi cho hỗn hợp tác dụng với HNO3 dư => Chỉ có Cu và Mg (kim loại thay đổi số oxi hóa)
BT e: nCu=(3nNO-2nMg)/2=0,15 mol
=>mCu=0,15.64=9,6 gam

Ta có: \(n_{Mg}=\dfrac{3,96}{24}=0,165\left(mol\right)\)
BT e, có: 2nMg = 3nNO + 10nN2 = 0,33 (1)
Mà: \(d_{\left(NO,N_2\right)/H_2}=14,25\Rightarrow\dfrac{30n_{NO}+28n_{N_2}}{n_{NO}+n_{N_2}}=14,25.2\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{NO}=0,01\left(mol\right)\\n_{N_2}=0,03\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow V=\left(0,01+0,03\right).22,4=0,896\left(l\right)\)

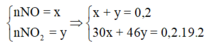
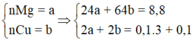

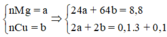

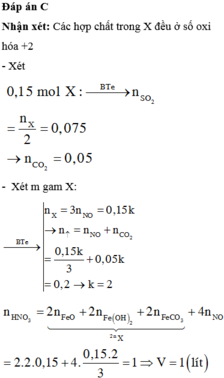
Gọi số mol N2O, N2 là a, b (mol)
Có: \(\overline{M}_A=\dfrac{44a+28b}{a+b}=18,45.2=36,9\left(g/mol\right)\)
=> 7,1a = 8,9b (1)
PTHH: 8Fe + 30HNO3 --> 8Fe(NO3)3 + 3N2O + 15H2O
\(\dfrac{8}{3}a\)<-------------------------------a
10Fe + 36HNO3 --> 10Fe(NO3)3 + 3N2 + 18H2O
\(\dfrac{10}{3}b\)<------------------------------b
=> \(\dfrac{8}{3}a+\dfrac{10}{3}b=\dfrac{4,48}{22,4}=0,2\) (2)
(1)(2) => \(\left\{{}\begin{matrix}a=\dfrac{89}{2370}\left(mol\right)\\b=\dfrac{71}{2370}\left(mol\right)\end{matrix}\right.\) => \(V=\left(\dfrac{89}{2370}+\dfrac{71}{2370}\right).22,4=\dfrac{1792}{1185}\left(l\right)\)